Bac Centres étrangers 2021 Sujet 2
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ2G11
Mots-clés : synthèse chimique, optimisation d’une synthèse.
Pour des raisons économiques, l’arôme de rhum des produits industriels est souvent d’origine synthétique.
Le méthanoate d’éthyle est un additif alimentaire à odeur de rhum. Il est obtenu par la réaction entre l’acide méthanoïque et l’éthanol. Cette transformation chimique est modélisée par la réaction d’équation suivante :
CH2O2(ℓ) + C2H6O(ℓ) ![]() C3H6O2(ℓ) + H2O(ℓ)
C3H6O2(ℓ) + H2O(ℓ)
L’objectif de l’exercice est de comparer deux protocoles permettant de réaliser cette synthèse.
Données :
| Formule brute | Masse volumique (g ⋅ cm−3) | Température d’ébullition (°C à 𝑃atm) | Masse molaire (g ⋅ mol−1) | |
| Acide méthanoïque | CH2O2 | 1,22 | 100,7 | 46,0 |
| Ethanol | C2H6O | 0,79 | 78,5 | 46,0 |
| Méthanoate d’éthyle | C3H6O2 | 0,91 | 54,3 | 74,0 |
| Eau | H2O | 1,00 | 100,0 | 18,0 |
Caractéristiques des réactifs et des produits à 25 °C
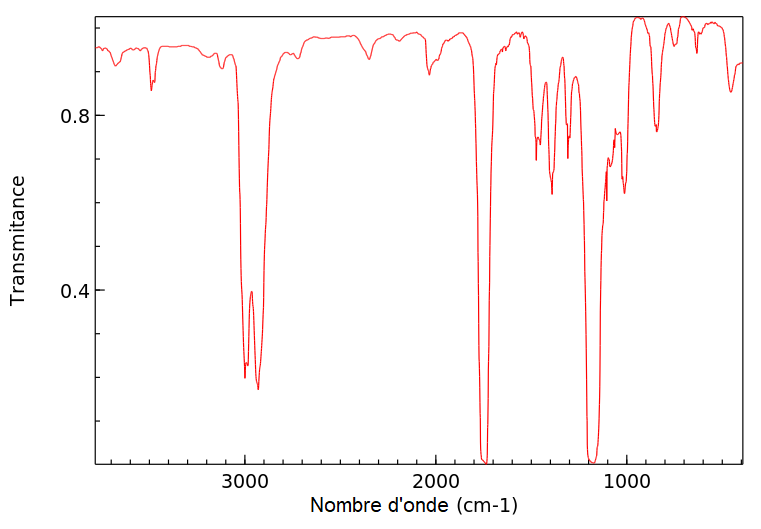
- Spectroscopie Infrarouge (IR)
| Type de liaison | (en cm−1) | Intensité et largeur de la bande d’absorption |
| O-H en phase gazeuse | 3500 – 3700 | moyenne, fine |
| O-H en phase condensée | 3200 – 3400 | forte, large |
| O-H d’un acide carboxylique | 2500 – 3200 | moyenne à forte, large |
| C-H des groupes CH2, CH3, CH | 2900 – 3100 | moyenne à forte, variable (bandes multiples) |
| C=O d’un acide carboxylique | 1680 – 1710 | forte, fine |
| C=O aldéhyde et cétone | 1650 – 1730 | forte, fine |
| C=O ester | 1700 – 1740 | forte, fine |
| C-O ester | 1050 – 1300 | forte, fine |
Protocole 1 :
Dans un ballon de 250 mL contenant 1,20 mol d’éthanol, quatre gouttes de solution d’acide sulfurique concentré (H2SO4) et quelques grains de pierre ponce, on ajoute 1,20 mol d’acide méthanoïque. On chauffe à reflux jusqu’à l’obtention de tout l’ester possible. À l’état final, le mélange réactionnel contient 0,40 mol d’acide méthanoïque, 0,40 mol d’éthanol, 0,80 mol de méthanoate d’éthyle et 0,80 mol d’eau.
Protocole 2 :
Dans un ballon, on mélange 37,7 mL d’acide méthanoïque, 29,1 mL d’éthanol et 5 mL d’acide sulfurique concentré. On distille le mélange. La température en tête de colonne augmente tout d’abord puis se stabilise autour de 55 ° C. On cesse la récupération du distillat dès que la température amorce une remontée. On obtient un volume de 32 mL de distillat, dont on mesure la masse ; on obtient une valeur de 29,0 g.
1. Écrire les formules développées de l’acide méthanoïque, de l’éthanol et de l’ester impliqués dans la synthèse.
2. Citer deux facteurs mobilisés dans ces deux protocoles pour améliorer la cinétique de la synthèse.
Montages utilisés
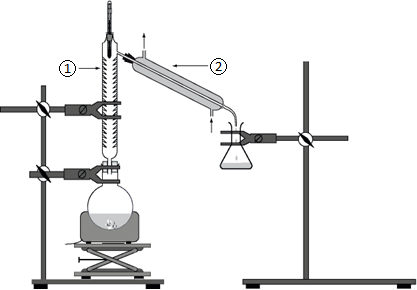
figure 1 : montage d’un des deux protocoles de synthèse.
3. Indiquer auquel des deux protocoles correspond le schéma de la figure 1.
4. Donner les noms des éléments de verrerie numérotés ➀ et ➁ sur le montage de la figure 1.
Comparaison des rendements des deux protocoles
À partir du protocole 1 :
5. Justifier, sans calcul, que la synthèse n’est pas une transformation totale.
6. Dresser un tableau d’avancement faisant apparaitre l’avancement final 𝑥f.
7. Définir le rendement de la transformation chimique étudiée. Calculer le rendement 𝜂1 pour ce premier protocole.
8. Proposer deux arguments pour justifier le fait que 𝜂2 soit supérieur à 𝜂1.
Identification du produit du protocole 2
On souhaite s’assurer que le distillat obtenu dans le protocole 2 est constitué de méthanoate d’éthyle.
9. Relever une observation pendant l’expérience permettant de rendre compte du fait que le distillat est constitué de méthanoate d’éthyle.
10. Déterminer la masse volumique du distillat et discuter le résultat obtenu.
11. L’enregistrement du spectre infrarouge du distillat obtenu lors de la mise en œuvre du protocole 2 est représenté figure 2. Discuter la compatibilité de ce spectre avec l’espèce chimique attendue dans le distillat.