Bac Métropole Septembre 2021 Sujet 1
Exercice 1 – (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 21-PYCJ1ME3
L’éthanoate de 3-méthylbutyle est une espèce chimique odorante présente notamment dans les pommes mûres. Son odeur agréable et sa faible toxicité permettent de l’utiliser comme arôme dans les bonbons. Cette espèce chimique appartient à la famille fonctionnelle des esters.
Cet exercice a pour objectif d’étudier dans un premier temps les espèces chimiques intervenant dans la synthèse de l’éthanoate de 3-méthylbutyle, puis d’étudier les conditions d’optimisation de cette synthèse.
Données :
- données physico-chimiques de quelques espèces chimiques :
| Nom de l’espèce chimique en nomenclature officielle | 3-méthylbutan-1-ol | Acide éthanoïque | Éthanoate de 3-méthylbutyle | Eau | Cyclohexane |
| Formule brute | C5H12O | C2H4O2 | C7H14O2 | H2O | C6H14 |
| Masse volumique (g·mL-1) à 25°C | 0,81 | 1,05 | 0,87 | 1,00 | 0,78 |
| Masse molaire (g·mol-1) | 88,1 | 60,0 | 130,2 | 18,0 | 84,2 |
| Solubilité dans l’eau à 25°C | Peu soluble | Très soluble | Très peu soluble | Très peu soluble |
- tableau de quelques bandes d’absorption infrarouge :
| Liaison | C = C | C = O | C – H | O – H d’un acide carboxylique | O – H d’un alcool |
| Nombre d’onde (cm-1) | 1 550 à 1 650 | 1 650 à 1 800 | 2 800 à 3 100 | 2 500 à 3 200 | 3 200 à 3 500 |
- règles de nomenclature :
– squelettes carbonés
Pour les hydrocarbures ramifiés, la position de la ramification sur la chaîne principale est indiquée par un chiffre et le groupeest indiquée par le préfixe. Des exemples de groupes sont donnés ci-dessous :
| Méthyl -CH3 | Éthyl -CH2-CH3 | Propyl -CH2-CH2-CH3 | Butyl -CH2-CH2-CH2-CH3 |
– famille fonctionnelle des esters
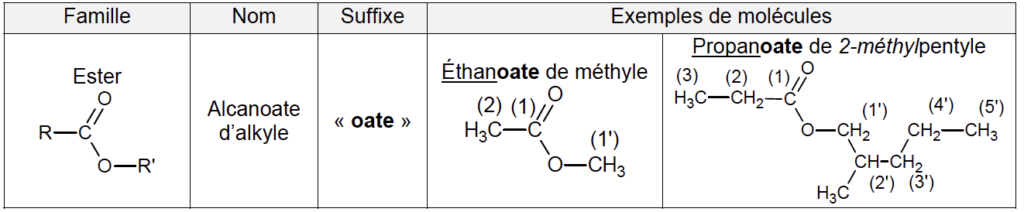
1. Des réactifs aux produits de la synthèse
Pour réaliser la synthèse de l’éthanoate de 3-méthylbutyle au laboratoire, on utilise les deux réactifs suivants : l’acide éthanoïque et le 3-méthylbutan-1-ol.
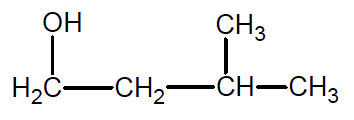
La représentation semi-développée du 3-méthylbutan-1-ol est :
1.1. Justifier le nom du 3-méthylbutan-1-ol.
1.2. Donner la représentation topologique du 3-méthylbutan-1-ol et entourer le groupe caractéristique de la molécule. Nommer la famille fonctionnelle correspondante.
1.3. On donne (figure 1) les spectres infrarouges des deux réactifs. Identifier, en justifiant, le spectre correspondant au 3-méthylbutan-1-ol.
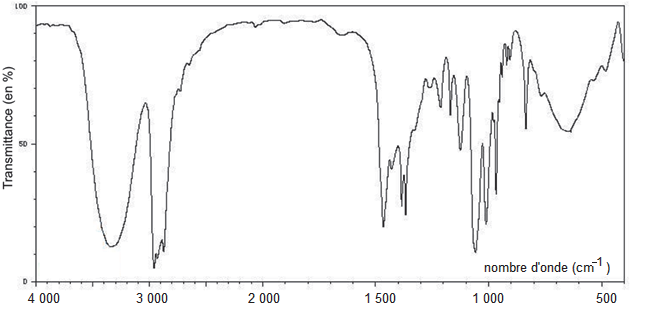
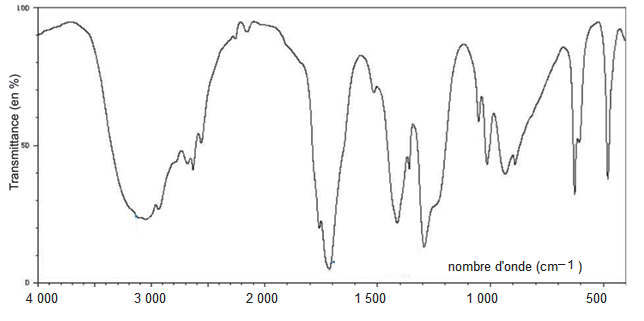
Figure 1. Spectres infrarouges des deux réactifs de la synthèse
1.4. Représenter la formule semi-développée de l’éthanoate de 3-méthylbutyle en exploitant les règles de nomenclature fournies.
2. Optimisation de la synthèse au laboratoire de l’éthanoate de 3-méthylbutyle
La synthèse de l’éthanoate de 3-méthylbutyle est une transformation lente et non totale.
Protocole de la synthèse :
Verser dans un ballon un volume V1 de 3-méthylbutan-1-ol, une masse m2 d’acide éthanoïque et un volume V3 d’acide sulfurique concentré.
Comme indiqué sur la figure 2, le ballon, surmonté d’un réfrigérant à air, est placé dans un bain-marie maintenant la température constante.
Pour montrer l’influence de certaines conditions expérimentales sur cette synthèse, quatre expériences sont réalisées. Le tableau ci-après présente les résultats expérimentaux pour quatre conditions différentes.
| Expérience 1 | Expérience 2 | Expérience 3 | Expérience 4 | |
| Température (°C) | 30 | 30 | 60 | 60 |
| Volume initial V1 de 3-méthylbutan-1-ol (mL) | 12,0 | 12,0 | 12,0 | 36,0 |
| Masse initiale m2 d’acide éthanoïque (g) | 6,62 | 6,62 | 6,62 | 6,62 |
| Volume V3 d’acide sulfurique (mL) | 0 | 0,5 | 0,5 | 0,5 |
| Ordre de grandeur du temps de demi-réaction | Plusieurs mois | Plusieurs heures | Une dizaine de minutes | Inférieur à une dizaine de minutes |
2.1. Écrire à l’aide des formules brutes, l’équation de la réaction modélisant la synthèse de l’éthanoate de 3-méthylbutyle, sachant qu’une autre espèce chimique à identifier est aussi produite. Justifier.
2.2. En exploitant les résultats expérimentaux, indiquer les conditions expérimentales permettant d’optimiser la cinétique de cette synthèse.
2.3. Détermination expérimentale du rendement de la synthèse de l’expérience 3.
2.3.1. Déterminer les quantités de matière des réactifs dans le mélange initial de l’expérience 3 et donner un qualificatif à ce mélange initial.
2.3.2. La masse d’éthanoate de 3-méthylbutyle obtenue en fin de réaction est de m3 = 6,20 g. Déterminer le rendement de la synthèse dans l’expérience 3. Commenter.
2.4. Détermination expérimentale du rendement de la synthèse de l’expérience 4.
À la fin de la synthèse, on sépare la phase aqueuse de la phase organique formée dans le ballon. Cette phase aqueuse contient l’acide éthanoïque qui n’a pas réagi et l’acide sulfurique. Ces deux acides sont responsables de l’acidité totale de la solution.
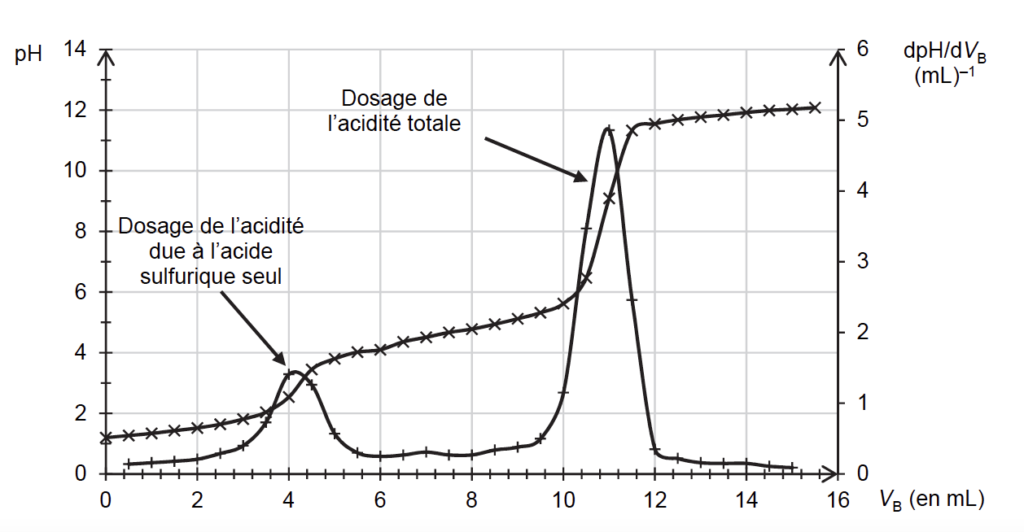
On réalise un titrage acido-basique de cette phase aqueuse, avec comme solution titrante une solution aqueuse d’hydroxyde de potassium (K+(aq) ; HO–(aq)) de concentration CB = 1,0 mol·L-1 . Ce titrage est suivi par pH-métrie et les courbes pH = f(VB) et dpH/VB = f(VB) sont représentées à la figure 3.
2.4.1. Écrire l’équation de la réaction support du titrage entre l’acide éthanoïque et l’ion hydroxyde.
2.4.2. Déterminer le volume d’hydroxyde de potassium nécessaire pour titrer l’acide éthanoïque.
2.4.3. En déduire la quantité de matière d’acide éthanoïque restant à la fin de la synthèse dans l’expérience 4.
2.4.4. Déterminer la quantité de matière d’ester formé et calculer le rendement de la synthèse dans l’expérience 4. En déduire un moyen d’optimiser le rendement de cette synthèse.
3. Amélioration du rendement de la synthèse grâce à l’utilisation d’un tube décanteur de Dean-Stark
On réalise de nouveau l’expérience 3 mais en utilisant un dispositif de Dean-Stark (voir figure 4), qui permet de séparer en continu l’eau formée du reste du milieu réactionnel.
Le tube décanteur de ce dispositif est initialement vide. Un volume de 30 mL de cyclohexane est ajouté initialement dans le milieu réactionnel, puis on chauffe à reflux le mélange réactionnel.
On suppose que seuls l’eau et le cyclohexane se vaporisent alors que les réactifs et l’éthanoate de 3-méthylbutyle restent dans le ballon. Le cyclohexane et l’eau se liquéfient dans le réfrigérant à eau et tombent dans le tube décanteur du Dean-Stark. Lorsque le tube décanteur est plein, l’excès de phase A s’écoule dans le mélange réactionnel.
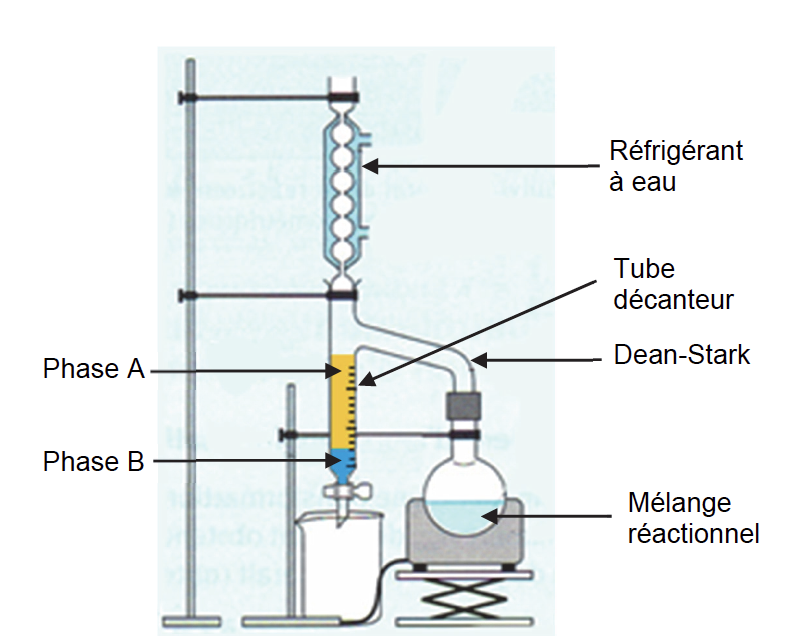
3.1. Identifier la nature des phases A et B présentes dans le tube décanteur. Justifier.
3.2. Indiquer l’intérêt de ce dispositif pour optimiser cette synthèse.
3.3. Lorsque la transformation est terminée, le volume d’eau recueilli dans le tube décanteur est de V = 1,8 mL. En déduire la quantité de matière d’ester formé. Conclure quant à l’efficacité de ce dispositif.
