Métropole Septembre 2022 Sujet 2
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2ME3
Mots-clés : synthèse organique
L’acide benzoïque, connu dans l’alimentation sous la dénomination E210, est aussi utilisé en tant que conservateur dans les cosmétiques. Cette molécule qui empêche le développement de bactéries est également autorisée dans les cosmétiques bio.
L’objectif de l’exercice est d’étudier les étapes de la synthèse de l’acide benzoïque en utilisant la réaction de Cannizzaro.
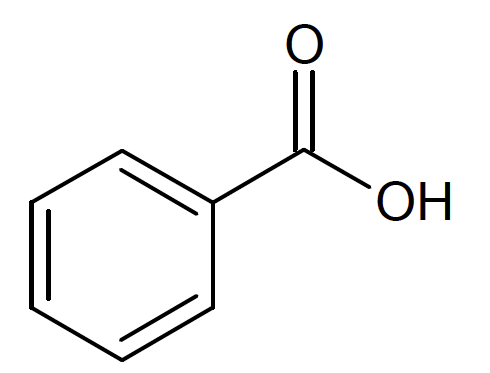
Figure 1. Formule topologique de l’acide benzoïque
Données :
| Espèce chimique | Masse molaire en g∙mol–1 | Densité | Solubilité dans l’eau | Solubilité dans l’éther diéthylique | Température de fusion en °C |
| Benzaldéhyde C7H6O | 106 | 1,05 | Très faible | Très grande | – 26 |
| Acide benzoïque C7H6O2 | 122 | Très faible | Faible | 122,3 | |
| Ion benzoate C7H5O2− | 121 | Très élevée | Très faible | ||
| Alcool benzylique C7H8O | 108 | 1,04 | Faible | Très grande | – 15 |
| Hydroxyde de potassium KOH | 56 | Très grande | Très faible | 360 | |
| Eau H2O | 18 | 1,0 | Insoluble | 0 | |
| Ether diéthylique C4H10O | 74 | 0,71 | Insoluble | – 116,3 |
- pKA à 25°C du couple acide benzoïque C7H6O2(aq) / ion benzoate C7H5O− (aq) : 4,2.
La synthèse de l’acide benzoïque à partir du benzaldéhyde met en jeu successivement deux transformations chimiques modélisées par les réactions d’équations indiquées ci-dessous.
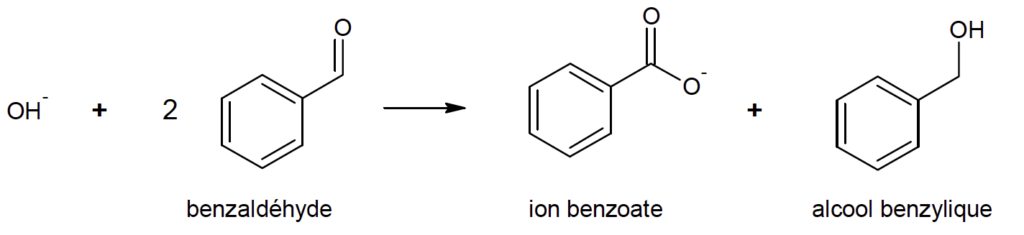
La réaction n°1, nommée réaction de Cannizzaro, a lieu en milieu très basique. Elle fait intervenir deux molécules de benzaldéhyde, l’une jouant le rôle d’oxydant et l’autre de réducteur.
- Réaction n°1 (réaction de Cannizzaro) :
- Réaction n°2 :
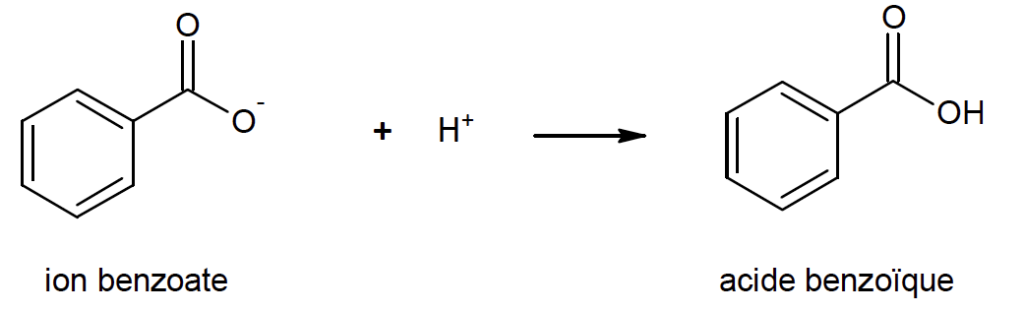
1. Étude de la réaction n°1 (réaction de Cannizzaro)
Q1. Représenter la formule semi-développée de l’acide benzoïque, entourer le groupe caractéristique et identifier la famille fonctionnelle correspondante.
Q2. Justifier, à l’aide d’un diagramme de prédominance, l’obtention de l’ion benzoate lors de transformation chimique modélisée par la réaction n°1.
Q3. Écrire la demi-équation électronique modélisant le transfert d’électrons entre le benzaldéhyde C7H6O(aq) et l’alcool benzylique C7H8O(aq), et identifier l’espèce oxydante et l’espèce réductrice du couple associé.
2. Étude du protocole expérimental
On donne ci-dessous un protocole expérimental permettant d’obtenir l’acide benzoïque par la réaction de Cannizzaro.
①
a) Dans un erlenmeyer, dissoudre une masse de 10 g d’hydroxyde de potassium dans 40 mL d’eau distillée.
b) Ajouter 5,0 mL de benzaldéhyde. Agiter vigoureusement, puis laisser sous agitation à température ambiante pendant 48 h.
②
c) Ajouter 20 mL d’éther diéthylique dans le milieu réactionnel, agiter, puis transvaser dans une ampoule à décanter.
d) Séparer la phase aqueuse de la phase organique.
e) Récupérer la phase aqueuse dans un erlenmeyer et la placer dans un bain d’eau glacée.
③
f) Sous la hotte, ajouter lentement dans la phase aqueuse, en agitant, une solution d’acide chlorhydrique jusqu’à pH = 2 : un solide blanc précipite.
④
g) Filtrer sur Büchner.
⑤
h) Introduire le produit obtenu dans un bécher avec 10 mL d’eau. Chauffer et ajouter la quantité d’eau juste nécessaire pour dissoudre le produit.
i) Laisser refroidir lentement puis filtrer sur un entonnoir Büchner pour récupérer le produit recristallisé.
j) Placer le produit à l’étuve puis peser le produit sec.
⑥
k) Réaliser la chromatographie sur couche mince du produit obtenu.
On obtient une masse m = 1,1 g de produit synthétisé.
On donne sur la figure 2 le résultat de la chromatographie sur couche mince (CCM) obtenue.
Les produits déposés sont en solution dans de l’éther diéthylique.
Dépôt A : benzaldéhyde commercial Dépôt B : acide benzoïque commercial Dépôt C : produit synthétisé.
La révélation se fait sous lampe UV.

Q4. Pour chaque étape du protocole numérotée de ① à ⑥ indiquer, sans justifier, si cette étape correspond à une transformation chimique de réactifs, à une analyse du produit synthétisé, à une purification ou à une séparation.
Q5. Proposer, en justifiant, un dispositif expérimental permettant d’optimiser la vitesse de formation du produit de synthèse.
Q6. Schématiser l’ampoule à décanter et son contenu en justifiant la position relative des deux phases. Indiquer, en justifiant, les phases dans lesquelles se situent l’ion benzoate et l’alcool benzylique produits lors de l’étape 1.
Q7. À l’étape f du protocole expérimental, justifier à l’aide des données l’apparition d’un solide.
Q8. Interpréter le résultat de la chromatographie sur couche mince obtenu.
Q9. Déterminer la valeur du rendement de la synthèse de l’acide benzoïque. Commenter.
