Polynésie 2022 Sujet 1
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 22-PYCJ1P01
Sujet et corrigé
Le benzoate de méthyle de formule C6H5COOCH3 est utilisé en parfumerie, il possède en effet une odeur agréable de goyave.
L’objectif de cet exercice est de déterminer le rendement de la synthèse en laboratoire du benzoate de méthyle par extraction de l’ester obtenu et par titrage de l’acide benzoïque restant.
1. Étude de la réaction de synthèse du benzoate de méthyle.
L’ester est synthétisé à partir d’acide benzoïque et de méthanol. L’équation de la réaction modélisant cette transformation chimique est donnée ci-dessous.
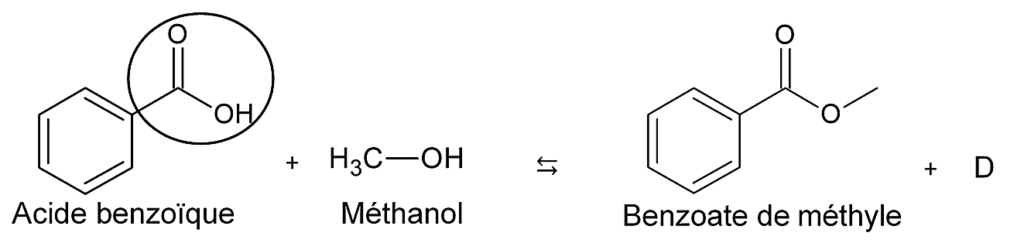
Figure 1. Équation de la réaction modélisant la transformation chimique
1.1. Nommer le groupe caractéristique entouré sur la molécule d’acide benzoïque.
Groupe carboxyle
1.2. Vérifier que la molécule D correspond à la molécule d’eau.
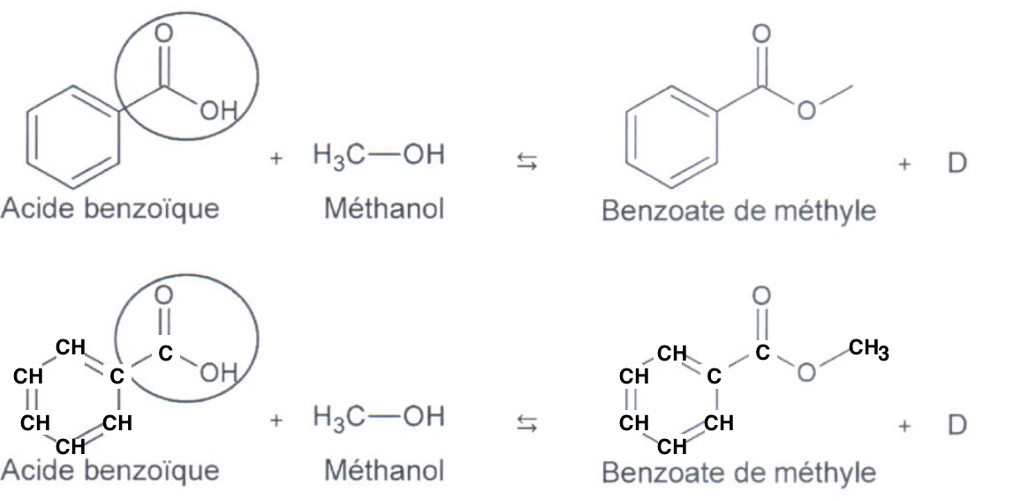
Réactifs :
C : 8
H : 10
O : 3
Produits
C : 8
H : 8
O : 2
Et l’élément D. Le nombre d’atome se conserve. On en déduit que D=H2O
2. Étude du mode opératoire.
Les étapes du protocole de synthèse de l’ester sont les suivantes :
Étape 1. Dans un ballon, introduire 12,2 g d’acide benzoïque, 4,0 mL de méthanol, 3 gouttes d’acide sulfurique concentré et quelques grains de pierre ponce. Chauffer à reflux sous la hotte pendant 1 heure sous ébullition douce.
Étape 2. Après refroidissement, verser le contenu du ballon dans une ampoule à décanter contenant environ 50 mL d’une solution saturée de chlorure de sodium (eau salée saturée).
Agiter en dégazant régulièrement et séparer la phase aqueuse de la phase organique.
Étape 3. Ajouter alors à la phase organique 50 mL d’une solution aqueuse d’hydrogénocarbonate de sodium (Na+(aq) + HCO3– (aq)). Dégazer puis séparer les deux phases après décantation.
Étape 4. Sécher la phase organique avec du chlorure de magnésium anhydre puis filtrer en recueillant le filtrat dans un erlenmeyer propre et sec.
2.1. Préciser le rôle de l’acide sulfurique ajouté dans l‘étape 1 du protocole de synthèse.
C’est un catalyseur
2.2. Identifier, parmi les montages représentés figure 2, celui correspondant à l’étape 1 du protocole de synthèse.
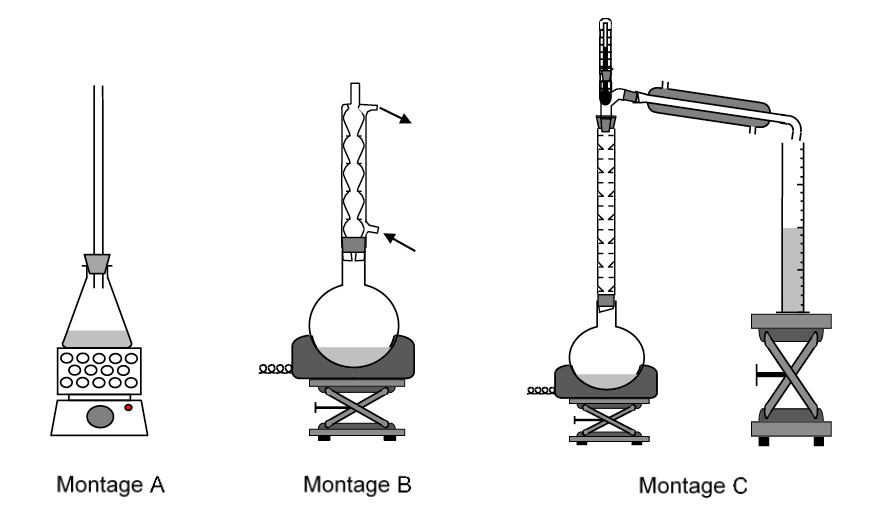
Figure 2. Montages de synthèse
Montage B
2.3. Donner un des intérêts du chauffage à reflux.
Accélérer la réaction sans perte de matière.
Données :
| Espèces chimiques | Acide benzoïque | Méthanol | Benzoate de méthyle | Eau salée saturée |
|---|---|---|---|---|
| Formule brute | C7H6O2 | CH4O | C8H8O2 | |
| Masse volumique (g·mL–1) | 0,79 | 1,1 | 1,2 | |
| Solubilité dans l’eau | Très faible | Très grande | Très faible | |
| Solubilité dans l’eau salée | Très faible | Très grande | insoluble | |
| Pictogrammes de sécurité | Corrosif : CMR*:  | Inflammable : Toxique :  CMR*:  |
CMR * : cancérogène, mutagène et neurotoxique
2.4. En étudiant les pictogrammes de sécurité des réactifs, justifier les précautions opératoires prises et citer les précautions d’usage.
L’acide benzoïque est corrosif : il faut donc porter gants, lunettes et blouse.
L’acide benzoïque et le méthanol sont CMR (cancérogène, mutagène et neurotoxique) : on travaille sous hotte aspirante.
Le méthanol est inflammable il faut l’éloigner de toutes sources de chaleur.
2.5. Expliquer le choix d’ajout d’eau salée dans l’étape 2 du protocole de synthèse.
Le produit à extraire : le benzoate de méthyle est très faiblement soluble dans l’eau mais insoluble dans l’eau salée.
Ainsi, en ajoutant du sel, on facilite l’extraction.
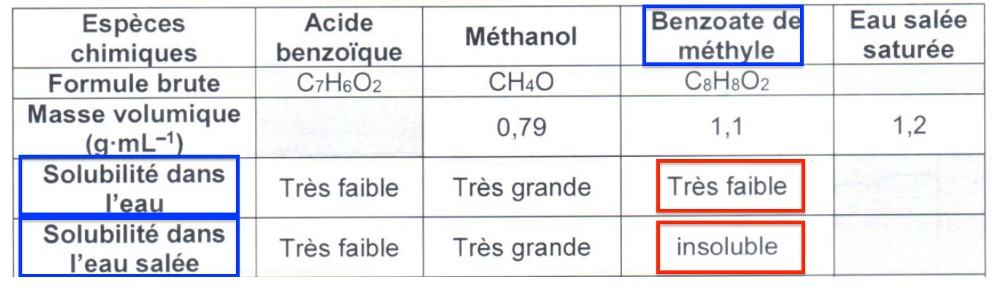
2.6. Identifier les espèces chimiques contenues dans chacune des deux phases mentionnées dans l’étape 2 du protocole de synthèse.
Phase aqueuse :
- Eau salée
- Méthanol
Phase organique :
- Acide benzoïque
- Benzoate de méthyle
Données :
- Couple acide carbonique / ion hydrogénocarbonate : CO2, H2O(aq) / HCO3– (aq) et demi-équation associée : CO2, H2O(aq) = HCO3– (aq) + H+. La valeur du pKA du couple acide carbonique / ion hydrogénocarbonate est égale à 6,4.
- Couple acide benzoïque / ion benzoate: C6H5COOH / C6H5COO–. La valeur du pKA du couple acide benzoïque / ion benzoate est égale à 4,2.
2.7. Montrer, par l’écriture d’une équation, que l’ajout de la solution aqueuse d’hydrogénocarbonate de sodium (Na+(aq)+ HCO3– (aq)) dans l’étape 3 du protocole de synthèse permet de transformer l’acide benzoïque C6H5COOH(s) restant en ion benzoate C6H5COO–(aq).
$$C_6H_5COOH_{(s)}+HCO_{3(aq)}^-\rightleftarrowsC_6H_5COO_{(aq)}^-+CO_2{,H_2O}_{(aq)}$$
3. Identification de la molécule obtenue par spectroscopie infrarouge.
Après l’étape 4 du protocole de synthèse, le spectre infrarouge en phase liquide de la molécule synthétisée a été réalisé.
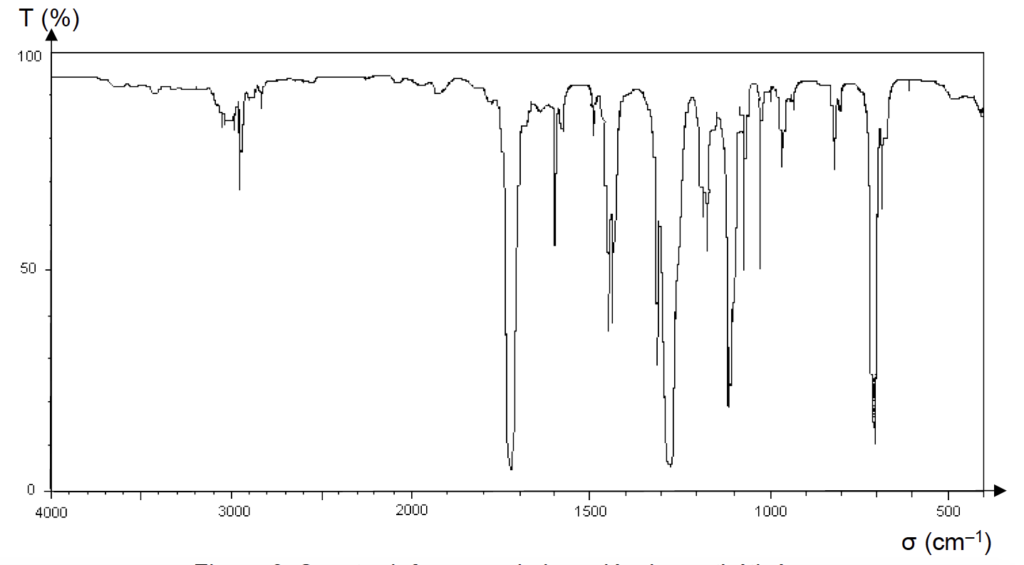
Figure 3. Spectre infrarouge de la molécule synthétisée
Données :
- Tableau de données de spectroscopie infrarouge (IR)
| Liaison | Nombre d’onde (cm–1) | Largeur de la bande | Intensité d’absorption |
| O–H liée | 3200 – 3400 | large | forte |
| O–H acide carboxylique | 2500 – 3200 | large | forte à moyenne |
| C–H | 2800 – 3000 | fine (bandes multiples) | faible |
| C=O | 1650 – 1740 | fine | forte |
| C–O | 1000 – 1300 | fine | forte |
3.1. En utilisant les données, montrer que le spectre de la figure 3 peut correspondre à la formule chimique du benzoate de méthyle.
Le benzoate de méthyle possède
Des liaisons C-H
Une liaison C=O
Une liaison C-O
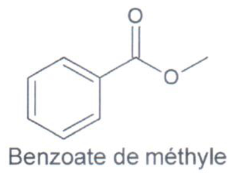
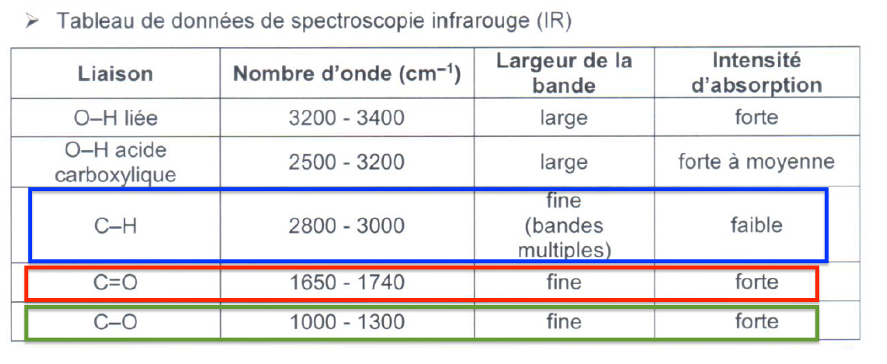
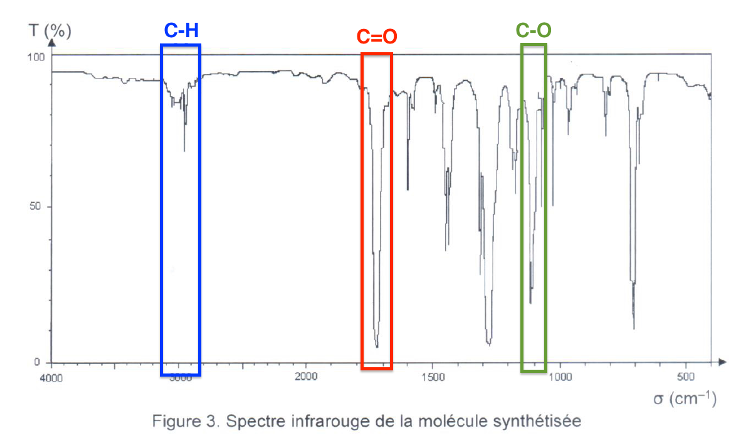
Le spectre comporte toutes les bandes attendues pour le benzoate de méthyle, il peut donc correspondre.
4. Rendement de la synthèse.
L’équation de la réaction modélisant la transformation chimique de synthèse du benzoate de méthyle est la suivante : C7H6O2(l) + CH4O(l) ⇆ C8H8O2(l) + H2O(l)
Données :
| Espèces chimiques | Acide benzoïque | Méthanol | Benzoate de méthyle | Eau salée saturée |
| Formule brute | C7H6O2 | CH4O | C8H8O2 | |
| Masse molaire (g·mol– 1) | 122 | 32,0 | 136 |
4.1. À l’aide des données présentes dans l’étape 1 du protocole de synthèse et celles ci-dessus, déterminer les quantités de matière des réactifs ni,alcool et ni,acide mis en présence.
$$ n_{i,\ alcool} = \frac{m_{méthanol}}{M_{méthanol}} $$
Or
$$ \rho_{méthanol} = \frac{m_{méthanol}}{V_{méthanol}} $$
$$ m_{méthanol} = \rho_{méthanol} \times V_{méthanol} $$
$$ n_{i,\ alcool} = \frac{\rho_{méthanol} \times V_{méthanol}}{M_{méthanol}} $$
$$ n_{i,\ alcool} = \frac{0,79 \times 4,0}{32,0} $$
$$ n_{i,\ alcool} = 9,9 \times 10^{-2}\ mol $$
$$ n_{i,\ acide} = \frac{m_{acide\ benzoique}}{M_{acide\ benzoique}} $$
$$ n_{i,\ acide} = \frac{12,2}{122} $$
$$ n_{i,\ acide} = 1,0 \times 10^{-1}\ mol $$
4.2. En déduire que ces réactifs ont été introduits dans les proportions stœchiométriques.
$$ x_{max1} = \frac{n_{i,\ alcool}}{1} = 9,9 \times 10^{-2}\ mol $$
$$ x_{max2} = \frac{n_{i,\ acide}}{1} = 1,0 \times 10^{-1}\ mol $$
$x_{max1} \approx x_{max2}$
Les réactifs ont été introduits dans les proportions stœchiométriques.
La masse expérimentale mexp obtenue de benzoate de méthyle est égale à 9,11 g.
4.3. Recopier sur votre copie et compléter le tableau d’avancement ci-dessous :
| Équation de la réaction | C7H6O2(l) | +CH4O(l) | ⇆ C8H8O2(l) | +H2O(l) | |
| État initial | x = 0 | ni,acide | ni,alcool | 0 | 0 |
| État intermédiaire | x | ||||
| État final | xf |
| Équation de la réaction | C7H6O2(l) | +CH4O(l) | ⇆ C8H8O2(l) | +H2O(l) | |
| État initial | x = 0 | ni,acide | ni,alcool | 0 | 0 |
| État intermédiaire | x | ni,acide– x | ni,alcool– x | x | x |
| État final | xf | ni,acide– xf | ni,alcool– xf | xf | xf |
4.4. Déterminer les valeurs des quantités de matière de l’ensemble des espèces présentes à l’état final notées nacide,eq, nalcool,eq, neau,eq et nester,eq correspondant à l’équilibre chimique.
$$ x_f = n_{ester,eq} $$
$$ x_f = \frac{m_{exp}}{M_{ester}} $$
$$ x_f = \frac{9,11}{136} $$
$$ x_f = 6,7 \times 10^{-2}\ mol $$
Déterminons les quantités de matière à l’état final :
$$ n_{acide,\ eq} = n_{i,\ acide} – x_f = 1,0 \times 10^{-1} – 6,7 \times 10^{-2} = 3,3 \times 10^{-2}\ mol $$
$$ n_{alcool,\ eq} = n_{i,\ alcool} – x_f = 9,9 \times 10^{-2} – 6,7 \times 10^{-2} = 3,2 \times 10^{-2}\ mol $$
$$ n_{ester,\ eq} = x_f = 6,7 \times 10^{-2}\ mol $$
$$ n_{eau,\ eq} = x_f = 6,7 \times 10^{-2}\ mol $$
4.5. Montrer que le rendement r de la synthèse s’approche de 67%.
$$ r = \frac{m_{exp}}{x_{max} \times M_{ester}} $$
$$ r = \frac{9,11}{1,0 \times 10^{-1} \times 136} $$
$$ r = 0,67 = 67% $$
4.6. Proposer une méthode permettant d’améliorer le rendement de cette synthèse.
On peut améliorer le rendement en séparant, au fur et à mesure, un des produits créés afin de déplacer l’équilibre.
5. Vérification de la quantité de matière en ions benzoate restante à l’aide d’un dosage spectrophotométrique.
À l’issue de la synthèse, l’ajout de la solution d’hydrogénocarbonate de sodium a permis la transformation de l’acide benzoïque C6H5COOH(aq) noté AH(aq) n’ayant pas réagi en ions benzoate C6H5COO–(aq) notés A–(aq).
On se propose de déterminer la quantité de matière d’ions benzoate restante, notée n(A–), dans la phase aqueuse de volume total égal à 100 mL en réalisant un dosage par spectrophotométrie.
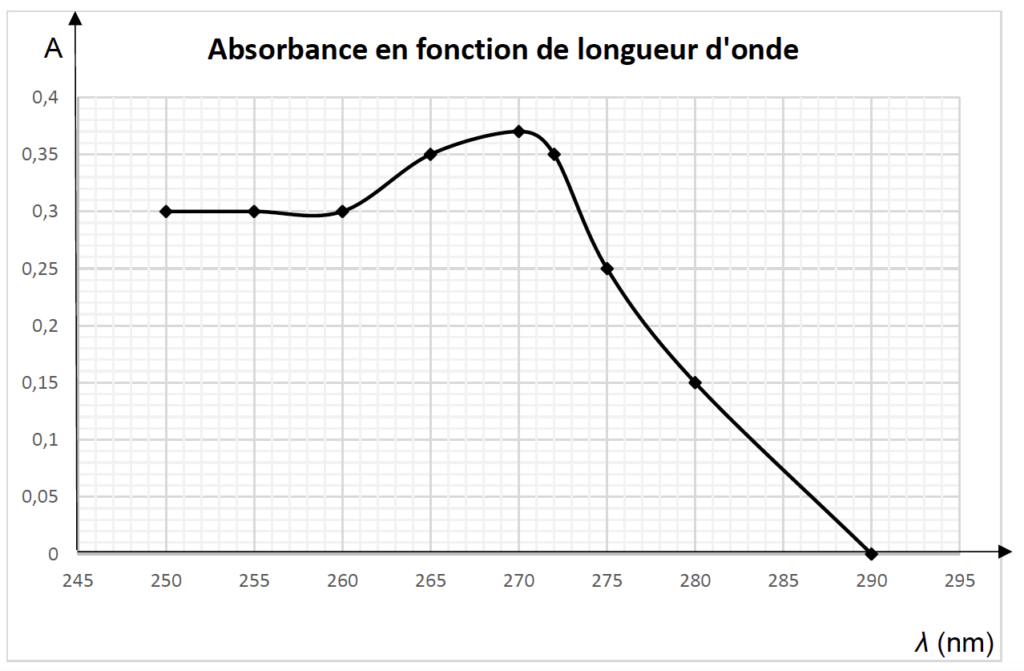
Figure 4. Spectre d’absorption des ions benzoate en solution aqueuse
5.1. À l’aide du graphe de la figure 4, expliquer à quelle longueur d’onde l le spectrophotomètre doit être réglé pour les futures mesures.
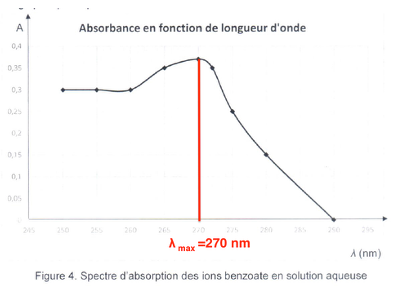
On choisit $\lambda_{max} = 270\ nm$ pour les futures mesures.
5.2. Identifier le domaine spectral dans lequel l’absorbance est maximale.
$\lambda_{max} = 270\ nm$ fait partie des ultraviolets.
On dilue 100 fois la solution aqueuse obtenue après la synthèse. À l’issue de la dilution, la nouvelle solution est appelée la solution S.
On réalise à partir d’une solution mère de benzoate de sodium S0 de concentration c0 = 1,0×10 – 2 mol.L-1 une gamme étalon constituée de 4 solutions diluées S1, S2, S3 et S4 versées dans des cuves de quartz identiques.
On rassemble les résultats dans le tableau de la figure 5.
| Solution Si | S0 | S1 | S2 | S3 | S4 |
| Concentration ci (mol·L–1) | 1,0×10–2 | 7,5×10–3 | 5,0×10–3 | 2,5×10–3 | 1,0×10–3 |
| Absorbance A | 0,880 | 0,661 | 0,441 | 0,221 | 0,087 |
Figure 5. Tableau des résultats du dosage spectrophotométrique La verrerie disponible au laboratoire est la suivante :
- Béchers de 50 mL, 25 mL, 100 mL
- Pipettes jaugées de 10,0 mL, 20,0 mL, 25,0 mL
- Fioles jaugées de 50,0 mL, 100,0 mL
5.3. Parmi la verrerie disponible, déterminer celles permettant de réaliser la préparation d’un volume V égal à 100,0 mL de solution S3 par dilution à partir de la solution mère S0.
Lors d’une dilution, la quantité de matière se conserve :
$$ n_0 = n_3 $$
$$ C_0V_0 = C_3V_3 $$
$$ V_0 = \frac{C_3V_3}{C_0} $$
$$ V_0 = \frac{2,5 \times 10^{-3} \times 100,0 \times 10^{-3}}{1,0 \times 10^{-2}} $$
$$ V_0 = 25,0 \times 10^{-3}\ L = 25,0\ mL $$
On choisit la pipette jaugée de 25,0 mL pour réaliser cette dilution.
Les mesures spectrophotométriques sont reportées dans la figure 6. On mesure également l’absorbance de la solution S : AS = 0,29.
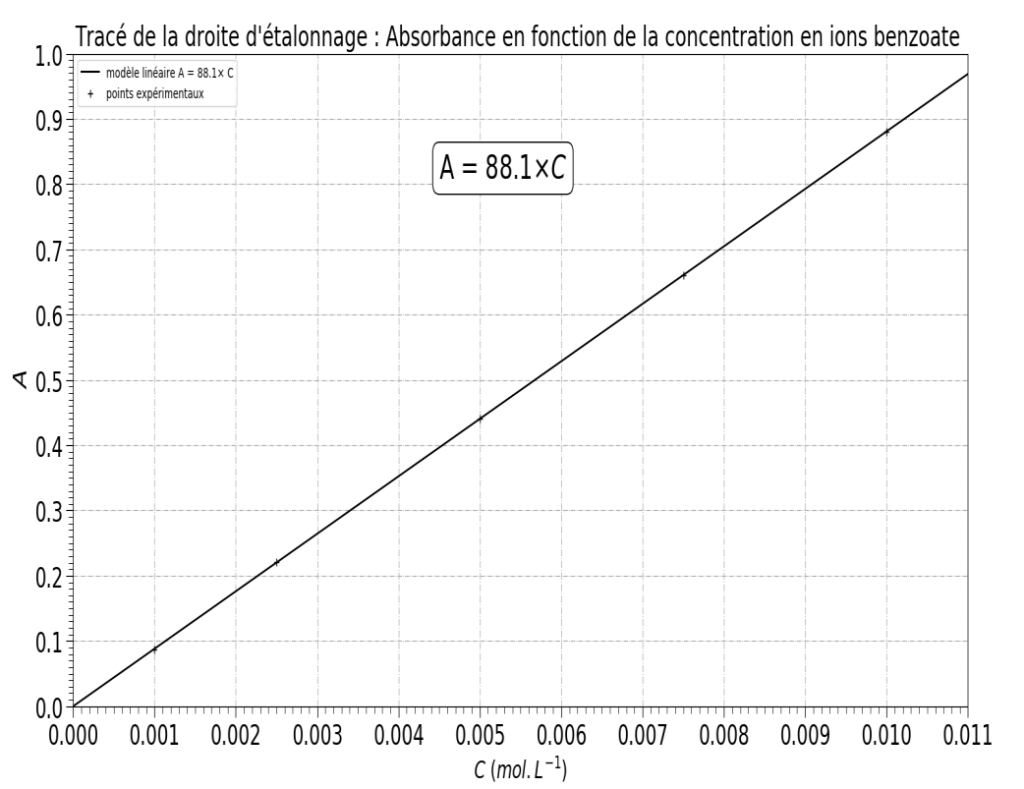
Figure 6. Évolution de l’absorbance en fonction de la concentration en ions benzoate
Dans la question suivante, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
5.4. Montrer que la quantité de matière en ions benzoate n(A–) restante dans la phase aqueuse issue de la réaction d’estérification est égale à 3,3×10–2 mol correspondant également à la quantité de matière d’acide benzoïque restant nacide,eq déterminée à la question 4.4.
D’après l’équation sur la figure 6 :
$$ A = 88,1 \times C $$
$$ A_S = 88,1 \times C_S $$
$$ C_S = \frac{A_S}{88,1} $$
$$ C_S = \frac{0,29}{88,1} $$
$$ C_S = 3,3 \times 10^{-3}\ mol.L^{-1} $$
Or la solution a été diluée 100 fois :
$$ C = 100 \times C_S = 100 \times 3,3 \times 10^{-3} = 3,3 \times 10^{-1}\ mol.L^{-1} $$
Calculons la quantité restante d’ions benzoate :
$$ n(A^-) = C \times V $$
$$ n(A^-) = 3,3 \times 10^{-1} \times 100,0 \times 10^{-3} = 3,3 \times 10^{-2}\ mol $$
$n(A^-)$ correspond à la quantité d’acide benzoïque n’ayant pas réagi :
$$ n_{acide,\ restant} = n(A^-) = 3,3 \times 10^{-2}\ mol $$
D’où
$$ n_{acide,\ restant} = n_{acide,\ eq} = 3,3 \times 10^{-2}\ mol $$
(Question 4.4.)
