Bac Asie 2021 Sujet 1
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1JA1
Mots-clés : couple acide-base, titrage suivi par spectrophotométrie, spectroscopie infrarouge.
Le varroa (destructor) est un acarien qui parasite les abeilles et entraîne la destruction de très nombreuses colonies d’abeilles dans le monde.
L’utilisation d’un diffuseur contenant une solution d’acide méthanoïque permet de l’éradiquer.
Cet exercice porte sur l’étude de quelques propriétés de l’acide méthanoïque, puis sur la détermination de la concentration en acide méthanoïque d’une solution commerciale pour la comparer à l’indication donnée par le fabricant : solution aqueuse contenant 65,0 g d’acide méthanoïque pour 100 mL de solution.

Source https://www.inrae.fr
Données :
- Formule développée de l’acide méthanoïque :
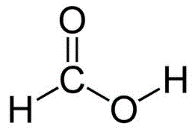
- Masse molaire moléculaire de l’acide méthanoïque : 𝑀 = 46,0 g ⋅ mol−1.
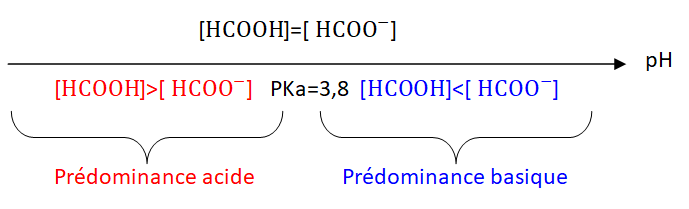
- p𝐾𝐴, à 25 °C, du couple acide méthanoïque / ion méthanoate : 3,8.
- Extrait de table de spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm−1) | Caractéristiques de la bande d’absorption |
| O – H alcool | 3200 – 3700 | forte, large |
| O – H acide carboxylique | 2600 – 3200 | forte à moyenne, large |
| C – H | 2800 – 3100 | forte ou moyenne |
| C = O | 1650 – 1740 | forte, fine |
Propriétés de l’acide méthanoïque
1. Citer la définition d’un acide selon la théorie de Brönsted et donner les noms de deux acides usuels.
Réponse :
Un acide est une espèce capable de céder un proton H+.
Acides usuels : acide chlorhydrique – acide éthanoïque
2. Donner la formule de l’ion méthanoate, base conjuguée de l’acide méthanoïque.
Réponse :
acide méthanoïque HCOOH . En retirant un proton H+, on trouve sa base conjuguée : l’ion méthanoate HCOO–
3. Représenter le diagramme de prédominance de l’acide méthanoïque et de sa base conjuguée. Justifier.
Réponse :
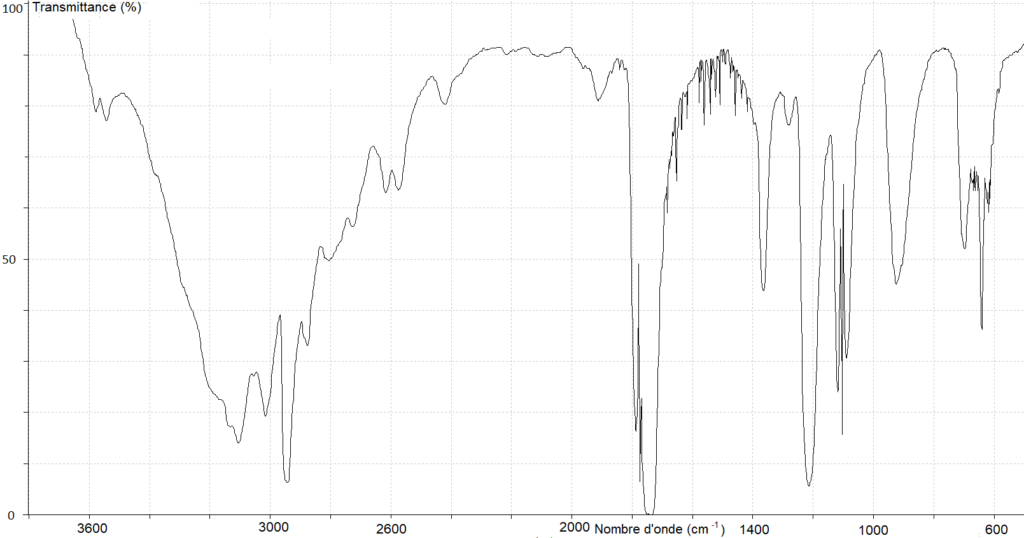
4. Parmi les trois spectres infrarouge A, B et C ci-après, identifier celui pouvant être attribué à l’acide méthanoïque. Justifier la réponse.
Spectre A
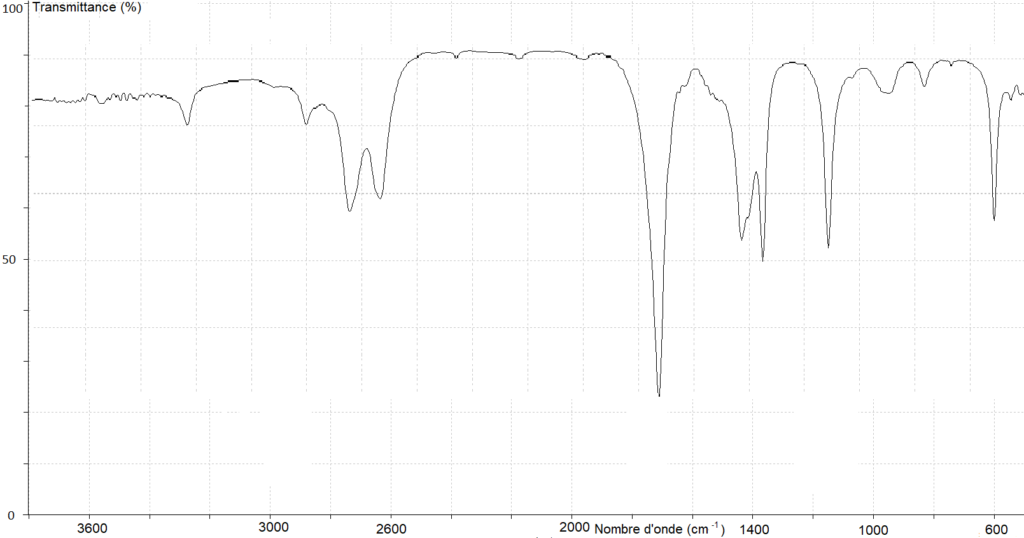
Spectre B
Spectre C
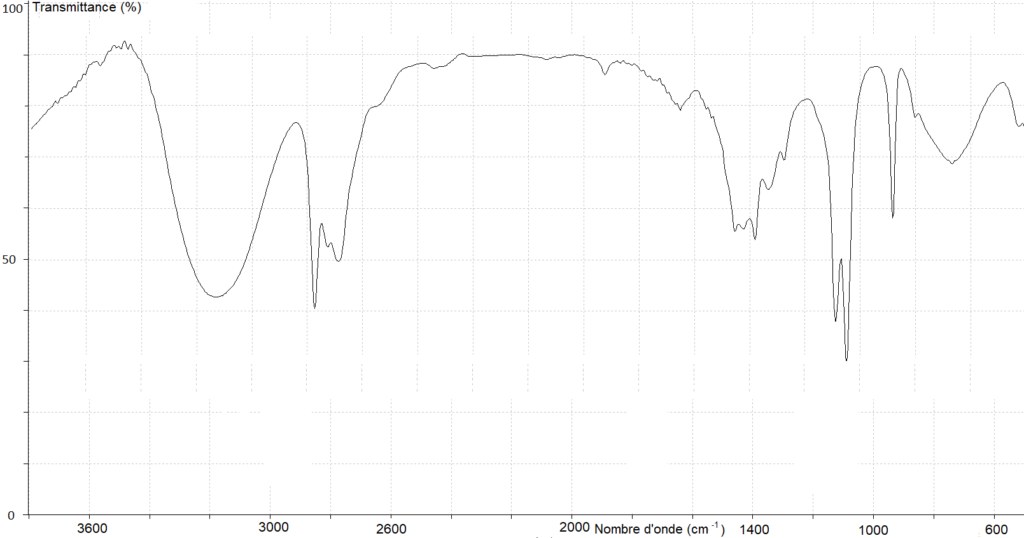
Source des spectres infrarouge : http://www.sciences-edu.net
Réponse :
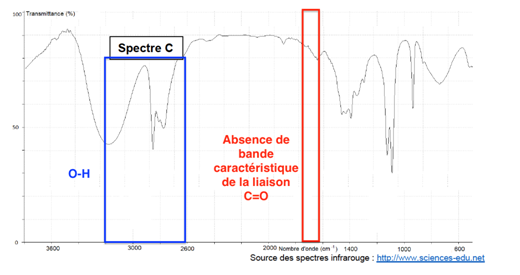
Pour la liaison O-H de l’acide carboxylique, il doit y avoir une bande comprise entre 2600 et 3200 cm-1. On exclu le spectre B.
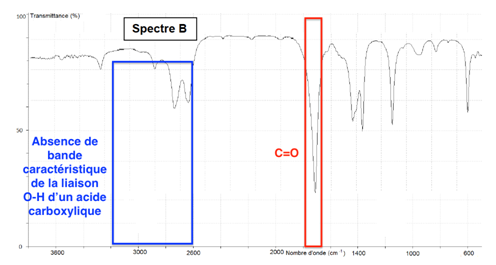
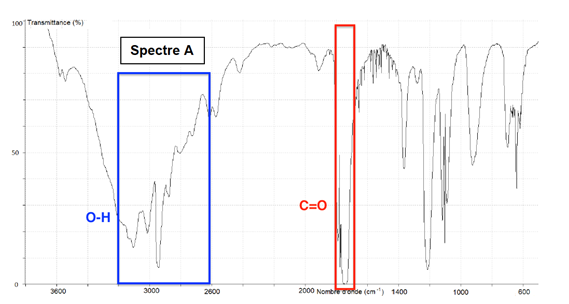
Pour la liaison C=O de l’acide carboxylique, il doit y avoir une bande comprise entre 1650 et 1740 cm-1. On exclu le spectre C.
Le spectre A possède ces deux bandes caractéristique des acides carboxylique.
Titrage de l’acide méthanoïque contenu dans la solution commerciale de traitement anti-acarien
Un titrage de l’acide méthanoïque contenu dans une solution commerciale de traitement anti-acarien par une solution aqueuse d’hydroxyde de sodium est réalisé en mettant en œuvre le protocole suivant.
Protocole du titrage :
- Diluer 1 000 fois la solution commerciale.
- Prélèver un volume 𝑉a = 20,0 mL de la solution diluée Sa de concentration 𝐶0.
- Titrer le prélèvement par une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO−(aq)) de concentration 𝐶b = 2,00 × 10−2 mol ⋅ L−1. Le suivi du titrage est effectué par pH-métrie.
- Utiliser un tableur-grapheur dans lequel sont entrées les différentes valeurs du pH mesurées en fonction du volume 𝑉b de solution d’hydroxyde de sodium ajoutée.
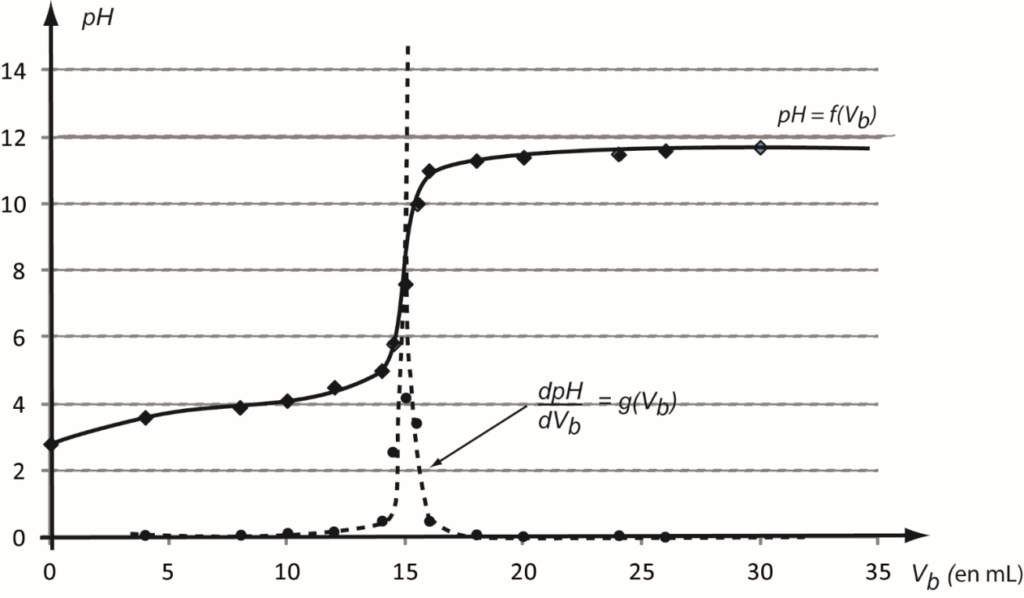
La courbe de titrage pH = f(𝑉b), ainsi que la courbe dp𝐻/d𝑉b= g(𝑉b) obtenues à l’aide des données du tableur- grapheur sont présentées sur la figure 1.
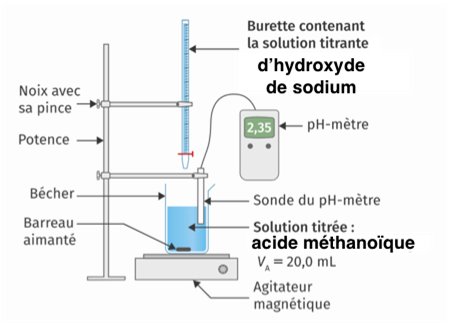
5. Faire un schéma légendé du dispositif expérimental utilisé pour réaliser le titrage.
Réponse :
6. Écrire, en la justifiant, l’équation de la réaction support du titrage.
Réponse :
L’acide méthanoïque HCOOH(aq) , réagit avec la solution d’hydroxyde de sodium (Na+(aq)+HO–(aq)). C’est une réaction acido basique, l’acide HCOOH(aq) cede un proton à la base HO–(aq) :
HCOOH(aq)+HO–(aq)→ HCOO–(aq)+H2O(l)
7. Montrer que la concentration d’acide méthanoïque de la solution diluée déterminée expérimentalement est égale à 𝐶0 = 15,0 × 10−3 mol ⋅ L−1.
Réponse :
A l’équivalence, les réactifs sont introduits dans des proportions stœchiométriques :
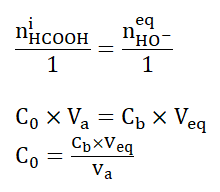
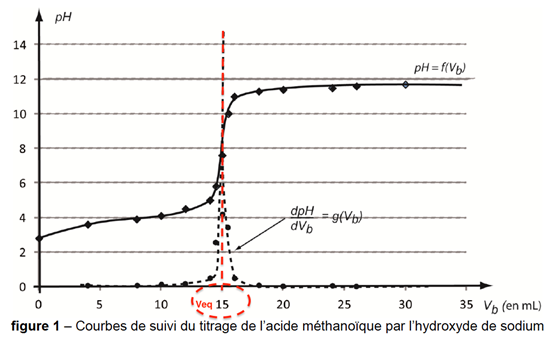
Vbeq est obtenu par lecture graphique : Vbeq=15 mL
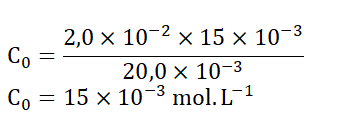
Dans les conditions de l’expérience, les incertitudes-type sur la concentration 𝐶b et sur les volumes 𝑉a , 𝑉eq (volume à l’équivalence) sont les suivantes :
u(𝐶b) = 0,02 × 10−2 mol ⋅ L−1 u(𝑉a) = 0,2 mL u(𝑉eq ) = 0,5 mL
L’incertitude-type sur la concentration 𝐶0 d’acide méthanoïque dans la solution diluée est déterminée à partir des valeurs et incertitudes-type sur 𝐶b, 𝑉a et 𝑉eq à partir de l’expression suivante :
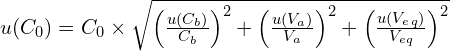
8. Écrire le résultat de la mesure de la concentration expérimentale 𝐶 de la solution commerciale assortie de son incertitude, sachant que dans les conditions expérimentales :
![]()
Réponse :
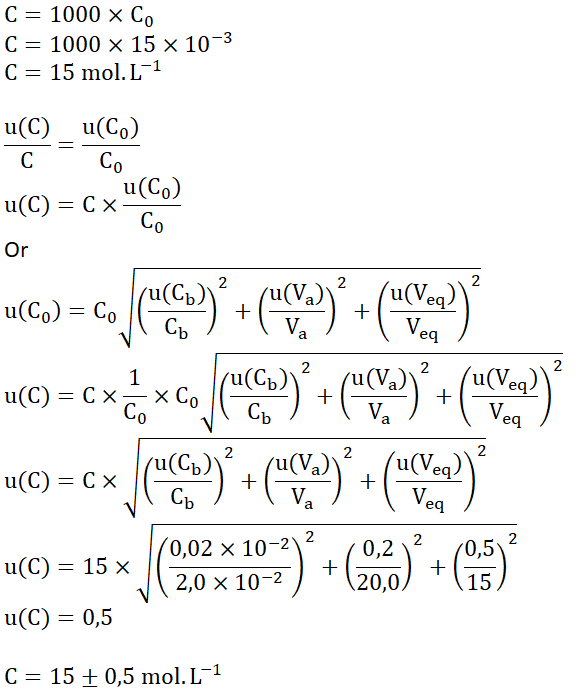
9. Confronter la concentration 𝐶 obtenue expérimentalement à la concentration indiquée par le fabriquant 𝐶fab en calculant le quotient ci-dessous. Conclure.
![]()
Réponse :
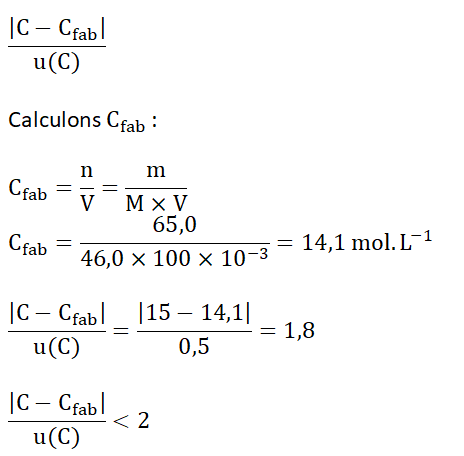
La mesure est compatible avec la valeur de la concentration indiquée par le fabriquant.
