Métropole Septembre 2025 Sujet 1
Exercice 3 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°25-PYCJ1ME3
Sujet et corrigé
Exercice 3 – Traitement de surface d’une pièce de jeu d’échecs (5 points)
Le procédé d’anodisation est un procédé de traitement de surface utilisé le plus souvent sur des pièces en aluminium.L’aluminium Aℓ(s) est transformé à la surface des pièces en alumine Aℓ2O3(s) au cours d’une électrolyse. Cette couche d’alumine permet ainsi de protéger la pièce de la corrosion et rend possible l’imprégnation d’un colorant.

On s’intéresse, dans cet exercice, au processus d’anodisation d’une pièce de jeu d’échecs en aluminium, ainsi qu’à sa coloration.
Données :
Pièce de jeu d’échecs après traitement de surface et coloration
| Formule | Masse molaire | Densité | Titre massique |
| H2SO4 | 98,1 g·mol–1 | 1,83 | 98 % |
Pictogramme

- masse molaire de l’alumine Aℓ2O3(s) : Malumine = 102 g·mol–1 ;
- masse volumique de l’eau : ρeau = 1,0 kg·L–1 ;
- couple oxydant/réducteur associé à l’alumine : Aℓ2O3(s) / Aℓ(s) ;
- couples oxydant/réducteur de l’eau : H+(aq) / H2(g) et O2(g) / H2O(ℓ) ;
- charge d’une mole d’électrons : F = 96 500 C·mol–1 ;
- on appelle anode l’électrode siège d’une oxydation et cathode l’électrode siège d’une réduction.
1. Préparation du bain d’anodisation sulfurique
Lors de son anodisation, une pièce de jeu d’échecs est plongée dans une solution aqueuse d’acide sulfurique à 18 °C. Cette solution est aussi appelée « bain d’anodisation » sulfurique.
Q1. Préciser, en justifiant, les précautions à prendre lors de la manipulation de l’acide sulfurique.
L’acide sulfurique est un acide très corrosif.
Les précautions à prendre lors de la manipulation de l’acide sulfurique sont :
- Porter des gants, des lunettes et une blouse pour éviter les contacts avec la peau et les yeux.
- En cas de dilution : verser l’acide dans l’eau et pas l’inverse.
Q2. Déterminer la masse d’acide sulfurique commercial à peser pour préparer 500 mL d’une solution aqueuse d’acide sulfurique de concentration 180 g·L–1.
$$c_m=\frac{m}{V}$$
$$\frac{m}{V}=c_m$$
$$m=c_m\times V$$
$$m=180\times 500,0\times {10}^{-3}$$
$$m=90\ g$$
La masse d’acide sulfurique à peser est de 90 g.
2. Anodisation de la pièce de jeu d’échecs
La pièce de jeu d’échecs, après avoir été nettoyée de manière appropriée, est immergée dans le bain d’anodisation où se déroule l’électrolyse. Elle constitue alors l’anode de l’électrolyse, la cathode étant une électrode en graphite inerte.

Q3. Indiquer si la transformation qui se déroule lors d’une électrolyse est une transformation d’oxydoréduction spontanée ou forcée.
Lors d’une électrolyse, la transformation est une réaction d’oxydoréduction forcée, car elle est provoquée par un apport d’énergie électrique.
Q4. Écrire la demi-équation électronique modélisant la transformation électrochimique de l’aluminium en alumine, puis justifier que la pièce de jeu d’échecs à traiter constitue l’anode de l’électrolyse.
Couple oxydant/réducteur associé à l’alumine : Aℓ2O3(s) / Aℓ(s)
Demi-équation électronique modélisant la transformation électrochimique de l’aluminium en alumine,
$$2Al\left(s\right)+3H_2O\left(l\right)={\rm Al}_2O_3\left(g\right)+6H^+\left(aq\right)+6e^-$$
L’aluminium perd des électrons (oxydation), donc la pièce de jeu d’échecs à traiter constitue l’anode de l’électrolyse.
La cathode est le siège de la réduction de l’eau.
Q5. Écrire la demi-équation électronique modélisant la réduction de l’eau, puis justifier l’observation d’un dégagement gazeux au niveau de l’électrode en graphite.
Couples oxydant/réducteur de l’eau : H+(aq) / H2(g) et O2(g) / H2O(ℓ)
Remarque : le sujet nous donne le couple oxydant/réducteur de l’eau H+(aq) / H2(g). Or dans ce couple il n’y a pas l’eau ! Il doit s’agir du couple H2O(ℓ)/ H2(g)
La cathode est le siège de la réduction de l’eau.
L’eau joue donc le rôle d’oxydant
$$H_2O\left(l\right)+2H^+\left(aq\right)+2e^-=H_2\left(g\right)+H_2O\left(l\right)$$
Ce qui revient à :
$$2H^+\left(aq\right)+2e^-=H_2\left(g\right)$$
(On comprend le couple donné H+(aq) / H2(g) au vu de cette demi équation)
Cette réaction à la cathode produit du dihydrogène H2 (g) qui est un gaz.
C’est ce qui explique l’observation d’un dégagement gazeux au niveau de l’électrode en graphite.
Q6. En déduire que l’équation de réaction modélisant cette électrolyse s’écrit :
2 Aℓ(s) + 3H2O(ℓ) → Aℓ2O3(s) + 3 H2(g)
$$2Al\left(s\right)+3H_2O\left(l\right)={\rm Al}_2O_3\left(g\right)+6H^+\left(aq\right)+6e^-$$
$$3\times\ 2H^+\left(aq\right)+2e^-=H_2\left(g\right)$$
$$2Al\left(s\right)+3H_2O\left(l\right)+6H^+\left(aq\right)={\rm Al}_2O_3\left(g\right)+6H^+\left(aq\right)+3H_2\left(g\right)$$
$$2Al\left(s\right)+3H_2O\left(l\right)={\rm Al}_2O_3\left(g\right)+3H_2\left(g\right)$$
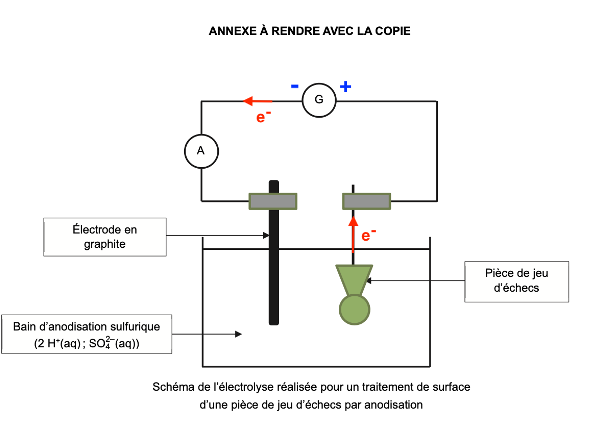
Q7. Indiquer, sur le schéma du montage de l’électrolyse de l’ANNEXE À RENDRE AVEC LA COPIE :
- le sens de déplacement des électrons ;
- les bornes + et – du générateur ;
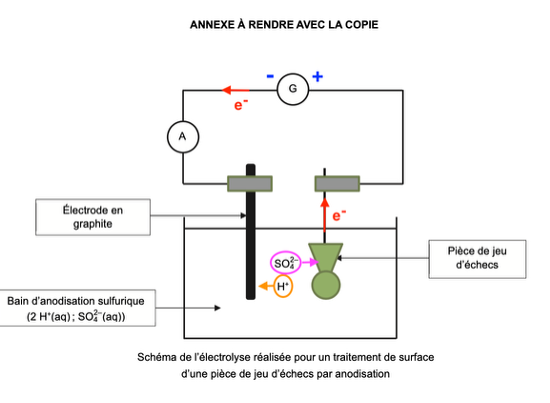
- le sens de déplacement des cations H+(aq) et des anions SO42– (aq) dans la solution entre les électrodes.
Sens de déplacement des électrons : la pièce de jeu d’échecs à traiter en aluminium perd des électrons (Question Q4). Les électrons partent de la pièce de jeu d’échecs à traiter en aluminium.
Bornes + et – du générateur : Les électrons partent de la pièce de jeu d’échecs à traiter en aluminium, ils se dirigent vers la borne positive du générateur. De plus au niveau de l’électrode en graphite, des électrons sont consommés ils partent de la borne négative du générateur vers l’électrode en graphite.
Sens de déplacement des cations H+(aq) et des anions SO42– (aq) dans la solution entre les électrodes.
Les cations H+(aq) se transforment en dihydrogène H2(g) au niveau de l’électrode en graphite. Les cations H+(aq) se déplacent donc vers l’électrode en graphite.
Les anions SO42– (aq) se déplacent donc vers la pièce de jeu d’échecs.
Durant les 40 minutes de l’électrolyse, le générateur débite un courant d’intensité constante et égale à 0,55 A.
Q8. Déterminer la masse théorique d’alumine Aℓ2O3(s) produite sur la pièce de jeu d’échecs au cours de cette électrolyse.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
$$n({\rm Al}_2O_3)=\frac{m({\rm Al}_2O_3)}{M({\rm Al}_2O_3)}$$
$$\frac{m({\rm Al}_2O_3)}{M({\rm Al}_2O_3)}=n({\rm Al}_2O_3)$$
$$m({\rm Al}_2O_3)=n({\rm Al}_2O_3)\times M({\rm Al}_2O_3)$$
$$2Al\left(s\right)+3H_2O\left(l\right)={\rm Al}_2O_3\left(g\right)+6H^+\left(aq\right)+6e^-$$
D’après la demi-équation électronique modélisant la transformation électrochimique de l’aluminium en alumine :
$$n({\rm Al}_2O_3)=\frac{n(e^-)}{6}$$
D’où
$$m({\rm Al}_2O_3)=\frac{n(e^-)}{6}\times M({\rm Al}_2O_3)$$
Or
$$Q=n(e^-)\times F$$
$$n\left(e^-\right)\times F=Q$$
$$n\left(e^-\right)=\frac{Q}{F}$$
D’où
$$m({\rm Al}_2O_3)=\frac{\frac{Q}{F}}{6}\times M({\rm Al}_2O_3)$$
$$m({\rm Al}_2O_3)=\frac{Q}{6\times F}\times M({\rm Al}_2O_3)$$
Or
$$Q=I\times \Delta t$$
D’où
$$m({\rm Al}_2O_3)=\frac{I\times \Delta t}{6\times F}\times M({\rm Al}_2O_3)$$
$$m({\rm Al}_2O_3)=\frac{0,55\times 40\times 60}{6\times 96\ 500}\times 102$$
$$m({\rm Al}_2O_3)=0,23\ g$$
La masse théorique d’alumine Aℓ2O3(s) produite sur la pièce de jeu d’échecs au cours de cette électrolyse est de 0,23 g.
3. Coloration de la pièce de jeu d’échecs
La couche d’alumine formée lors de l’anodisation, de formule Aℓ2O3(s), est poreuse. Lors de la coloration, les pigments de couleur se fixent dans les pores à condition d’avoir une épaisseur d’alumine d’au moins 15 μm.
Données :
- masse volumique de l’alumine : ρalumine = 3,97 g·cm–3 ;
- masse d’alumine théorique formée lors de l’anodisation d’une pièce de jeu d’échecs : malumine = 0,23 g ;
- surface estimée d’une pièce de jeu d’échecs : S = 25 cm2.
Q9. En supposant un rendement d’anodisation de 100 %, déterminer si la coloration de la pièce de jeu d’échecs est possible suite à l’anodisation sulfurique.
D’après l’énoncé « lors de la coloration, les pigments de couleur se fixent dans les pores à condition d’avoir une épaisseur d’alumine d’au moins 15 μm. ».
Calculons l’épaisseur d’alumine formé :
$$V=S\times e$$
$$S\times e=V$$
$$e=\frac{V}{S}$$
Or
$$\rho=\frac{m}{V}$$
$$\rho\times V=m$$
$$V=\frac{m}{\rho}$$
D’ou
$$e=\frac{\frac{m}{\rho}}{S}$$
$$e=\frac{m}{\rho\times S}$$
$$e=\frac{0,23}{3,97\times 25}$$
$$e=2,5\times {10}^{-3}\ cm$$
$$e=2,5\times {10}^{-3}\times {10}^{-2}\ m$$
$$e=2,5\times {10}^{-5}\ m$$
$$e=2,5\times {10}^{-5}\times {10}^6\ \mu m$$
$$e=25\ \mu m$$
L’épaisseur formée de 25 μm est supérieure au minimum de 15 μm nécessaire à la coloration de la pièce de jeu d’échecs.
Ainsi, la coloration de la pièce de jeu d’échecs est possible suite à l’anodisation sulfurique.
Q10. L’épaisseur de la couche d’alumine est en réalité voisine de 19 μm. Calculer le rendement réel de cette anodisation.
L’épaisseur de la couche d’alumine est en réalité voisine de 19 μm.
La masse réelle d’alumine produite est :
$$\rho=\frac{m_{experimentale}}{V}$$
$$\frac{m_{experimentale}}{V}=\rho$$
$$m_{experimentale}=\rho\times V$$
Or
$$V=S\times e$$
D’où
$$m_{experimentale}=\rho\times S\times e$$
$$m_{experimentale}=3,97\times 25\times 19\times {10}^{-4}$$
$$m_{experimentale}=0,19\ g$$
Calculons le rendement réel de cette anodisation :
$$\eta=\frac{m_{experimentale}}{m_{theorique}}$$
$$\eta=\frac{0,19}{0,23}$$
$$\eta=0,83$$
$$\eta=83%$$
Le rendement est de 83%.
ANNEXE À RENDRE AVEC LA COPIE

Schéma de l’électrolyse réalisée pour un traitement de surface d’une pièce de jeu d’échecs par anodisation
