Bac Amérique du nord 2021 Sujet 1
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1AN1
Sujet et corrigé
Mots clés : dilution ; titrage avec suivi pHmétrique
Le manque de magnésium dans l’organisme se manifeste par des contractures, des tremblements, une fatigue, une tétanie…
Donnée : masse molaire du magnésium : M(Mg) = 24,3 g·mol-1.
On s’intéresse à un médicament qui aide à combler ce manque en apportant le magnésium sous forme d’ions magnésium Mg2+(aq) contenus dans des comprimés. Le but de cet exercice est de déterminer le nombre de comprimés de ce médicament qu’un patient pourrait prendre chaque jour pour compenser ce manque de magnésium.
Pour cela on réalise un protocole expérimental en deux étapes :
Première étape : substitution des ions magnésium dans la résine échangeuse d’ions.
On prépare, par dissolution d’un comprimé du médicament dans une fiole jaugée, un volume V = 250,0 mL d’une solution aqueuse notée S.
On introduit un échantillon de volume V1 = 25,0 mL de solution S par le haut d’une colonne contenant une résine. Celle-ci est constituée de billes poreuses saturées en ions oxonium H3O+(aq) échangeables. Au contact de la résine, tous les ions magnésium présents dans l’échantillon vont s’échanger avec les ions oxonium et prendre leur place sur la résine. La solution recueillie dans un bécher après le passage dans la résine est appelée l’éluat.
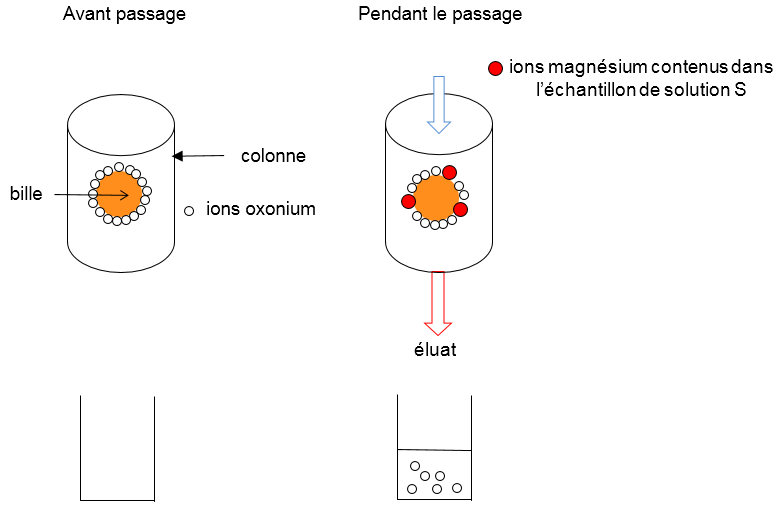
Pour chaque ion magnésium fixé, la résine libère deux ions oxonium.
Deuxième étape : dosage par titrage des ions oxonium dans l’éluat.
On dose ensuite, par pH-métrie, les ions oxonium contenus dans l’éluat par une solution d’hydroxyde de sodium.
On réalise le montage suivant :
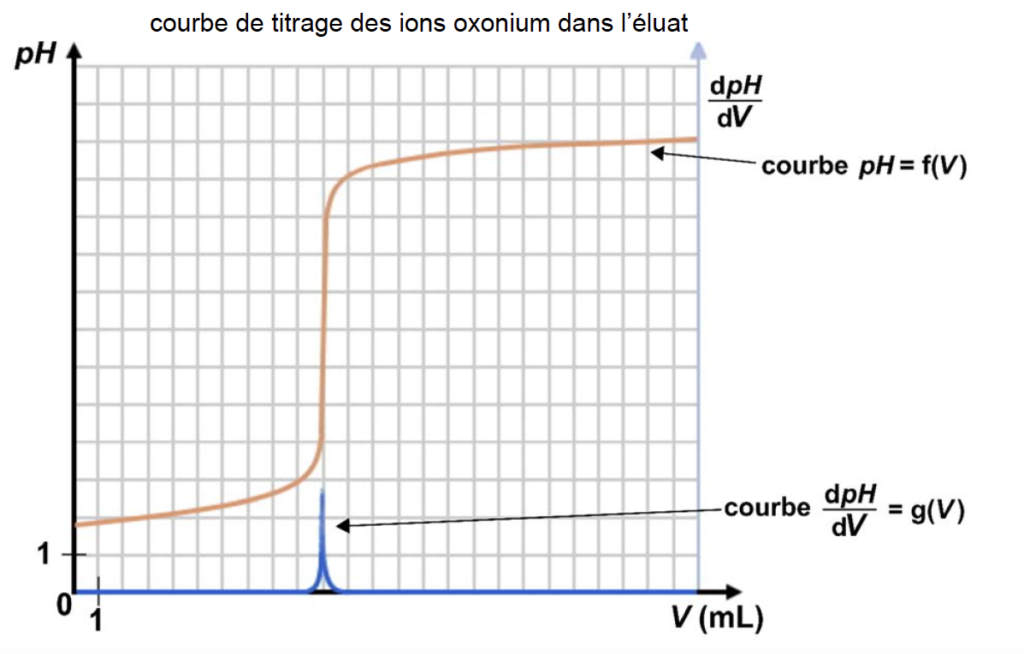
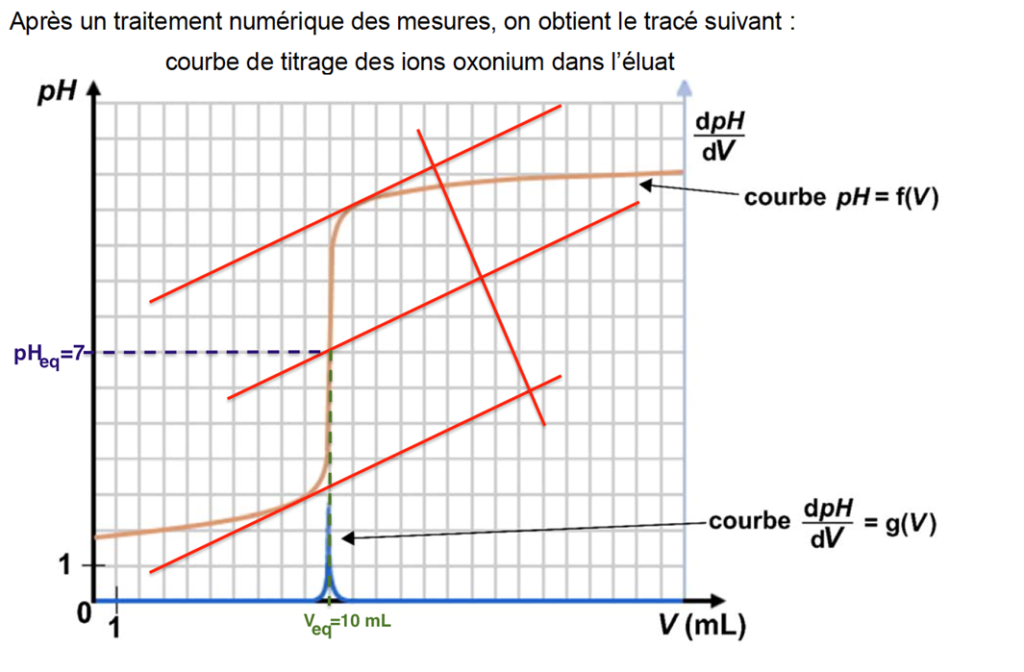
Après un traitement numérique des mesures, on obtient le tracé suivant :
La solution d’hydroxyde de sodium de concentration CB = 4,00 × 10-2 mol·L-1, utilisée pour le titrage est obtenue par dilution d’une solution mère S0 de concentration C0 = 1,00 × 10-1 mol·L-1.
On dispose de fioles jaugées (50,0 mL ; 100,0 mL ; 200,0 mL) et de pipettes jaugées (10,0 mL ; 20,0 mL ; 25,0 mL).
1. Indiquer la verrerie à utiliser pour effectuer cette dilution avec un seul prélèvement de S0. Expliquer la réponse.
Réponse :
La solution d’hydroxyde de sodium de concentration CB = 4,00 × 10-2 mol·L-1, utilisée pour le titrage est obtenue par dilution d’une solution mère S0 de concentration C0 = 1,00 × 10-1 mol·L-1.
Lors d’une dilution, la quantité de matière se conserve, Ainsi :
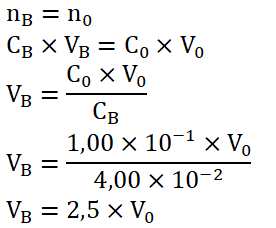
Le volume de la solution fille VB est 2,5 fois plus grand que le volume prélevé de la solution mère V0.
On choisi une pipette jaugée de 50 mL pour prélevé la solution mère V0 et une fiole jaugée de volume 20,0 mL pour le volume de la solution fille VB.
2. Écrire l’équation de la réaction support du titrage puis définir l’équivalence.
Réponse :
On dose ensuite, par pH-métrie, les ions oxonium contenus dans l’éluat par une solution d’hydroxyde de sodium.
H30++HO– → 2H2O
A l’équivalence, les réactifs sont introduits dans des proportions stœchiométriques
On dispose de trois indicateurs colorés acidobasiques.
| Indicateur coloré | Teinte de la forme acide | Zone de virage | Teinte de la forme basique |
| Hélianthine | rouge | 3,1 < pH < 4,4 | jaune |
| Bleu de bromothymol | jaune | 6,0 < pH < 7,6 | bleu |
| Jaune d’alizarine | jaune | 10,1 < pH < 12,0 | rouge |
3. Justifier, par un raisonnement détaillé, le choix possible de l’indicateur coloré pour suivre le dosage par titrage colorimétrique.
Réponse :
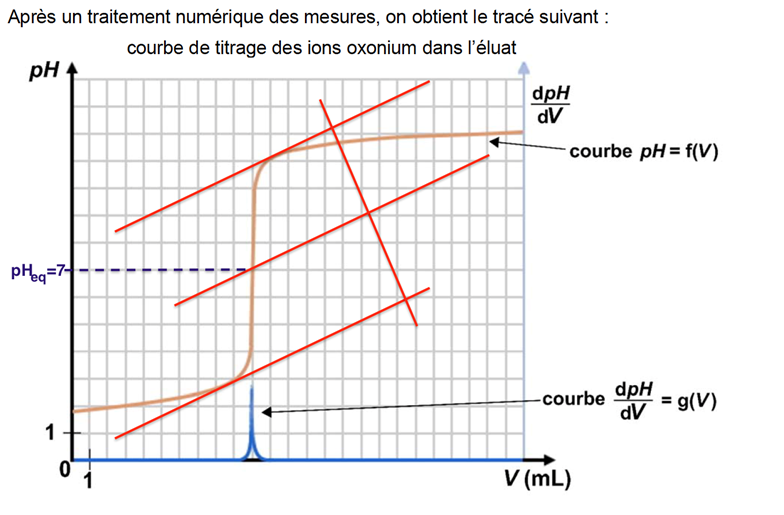
Pour choisir un indicateur coloré pour suivre le dosage par titrage colorimétrique, il faut que pHeq soit contenu dans sa zone de virage.
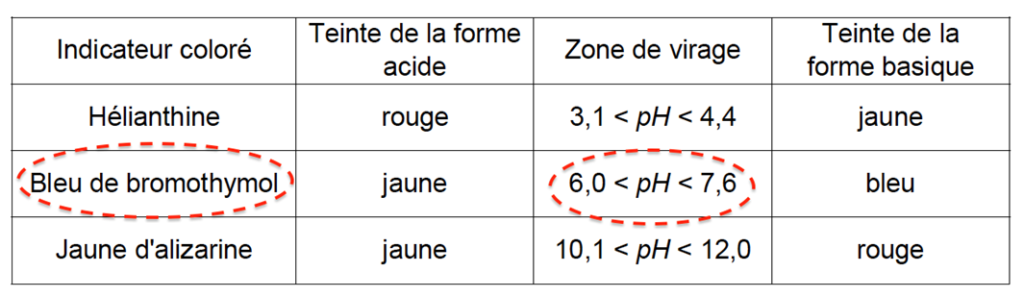
On choisit donc le Bleu de bromothymol.
4. Montrer que la quantité de matière d’ions oxonium dans l’éluat est égale à 4,0 × 10-4 mol.
Réponse :
A l’équivalence :
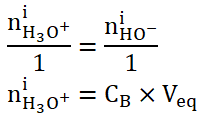
On trouve graphiquement Veq =10 mL.
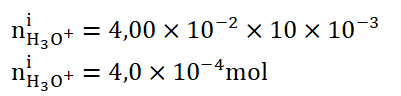
Pour les adultes, le besoin quotidien en magnésium est estimé à 6,0 mg par kilogramme de masse corporelle.
5. Résolution de problème : le candidat est invité à prendre des initiatives, à indiquer les hypothèses qu’il est amené à formuler et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite d’être correctement présentée.
Déterminer le nombre de comprimés de médicament qui apporteraient, à un adulte en manque de magnésium, la masse de magnésium préconisée par jour.
Porter un regard critique sur le résultat obtenu en proposant un moyen de réduire cette consommation médicamenteuse.
Réponse :
« Tous les ions magnésium présents dans l’échantillon vont s’échanger avec les ions oxonium et prendre leur place sur la résine. »
« Pour chaque ion magnésium fixé, la résine libère deux ions oxonium. »
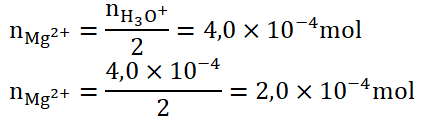
Calculons la masse d’ions contenue dans le volume V1 dosé :
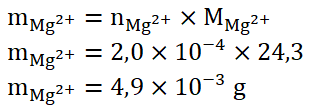
« On prépare, par dissolution d’un comprimé du médicament dans une fiole jaugée, un volume V = 250,0 mL d’une solution aqueuse notée S. On introduit un échantillon de volume V1 = 25,0 mL de solution S »
Calculons la masse d’ions contenu dans un comprimé :
| 4,9.10-3 g | 25,0 mL |
| m | 250,0 mL |
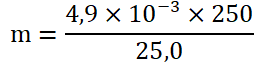
m=4,9.10-2 g dans un comprimé.
« Pour les adultes, le besoin quotidien en magnésium est estimé à 6,0 mg par kilogramme de masse corporelle. »
Considérons un adulte de 70 Kg, calculons la masse en magnésium correspondant à ses besoins :
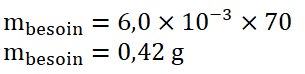
Calculons le nombre de comprimés de médicament qui apporteraient, à un adulte en manque de magnésium, la masse de magnésium préconisée par jour.
| 4,9.10-2 g | 1 comprimé |
| 0,42 g | N comprimés |
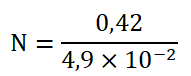
N=8,6 comprimés comprimés
Le nombre de comprimé est important.
Il faudrait manger des aliments contenant du magnésium pour réduire cette consommation médicamenteuse.
