Métropole 2025 Sujet 2
Exercice 3 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°25-PYCJ2ME1
Sujet et corrigé
Exercice 3 – Un parfum de rose (5 points)
Utilisés en parfumerie, le géraniol et l’éthanoate de géranyle sont deux espèces chimiques à l’odeur florale et fruitée naturellement présentes dans les huiles essentielles de rose, de palmarosa ou encore de citronnelle.

Si le géraniol peut être extrait en grande quantité dans la nature, cela n’est pas le cas de l’éthanoate de géranyle qui doit être synthétisé en laboratoire.
L’objectif de cet exercice est d’étudier quelques propriétés du géraniol et son utilisation dans la synthèse de l’éthanoate de géranyle.
Données :
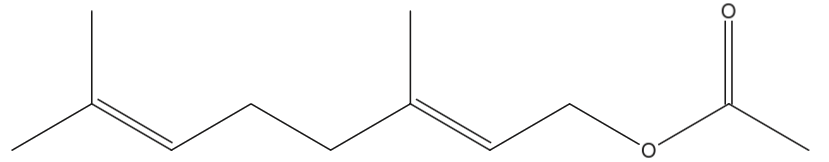
- représentation topologique du géraniol, noté G :

- représentation topologique de l’éthanoate de géranyle, noté EG :
- table de données de spectroscopie infrarouge :
| Liaisons | Nombre d’onde (cm–1) | Intensité |
| O – H alcool | 3 200 – 3 700 | Forte |
| O – H acide carboxylique | 2 500 – 3 200 | Forte et très large |
| C – H | 2 800 – 3 300 | Moyenne et fine |
| C = O | 1 700 – 1 800 | Forte et fine |
- masse molaire du géraniol : MG = 154,25 g·mol–1 ;
- masse molaire de l’éthanoate de géranyle : MEG = 196,29 g·mol–1 ;
- ordre de grandeur de la densité d’une solution aqueuse d’acide éthanoïque : dA = 1,0 ;
- densité du géraniol : dG = 0,89 ;
- densité de l’éthanoate de géranyle : dEG = 0,92.
1. Étude préliminaire
Q1. Nommer le groupe caractéristique entouré sur la représentation topologique du géraniol. Identifier les familles chimiques auxquelles appartiennent le géraniol et l’éthanoate de géranyle.
Groupe caractéristique entouré sur la représentation topologique du géraniol : Groupe Hydroxyle.
Famille chimique à laquelle appartient le géraniol : Alcool.
Famille chimique à laquelle appartient l’éthanoate de géranyle : Ester.
Q2. Attribuer, en justifiant, le spectre infrarouge représenté sur la figure 1 ci-après à la bonne espèce chimique parmi le géraniol et l’éthanoate de géranyle
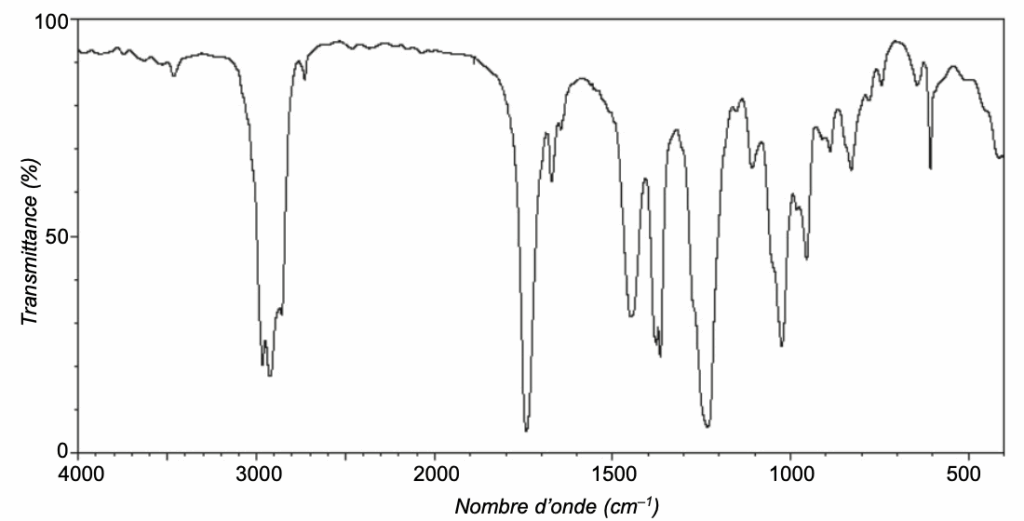
Figure 1. Spectre infrarouge
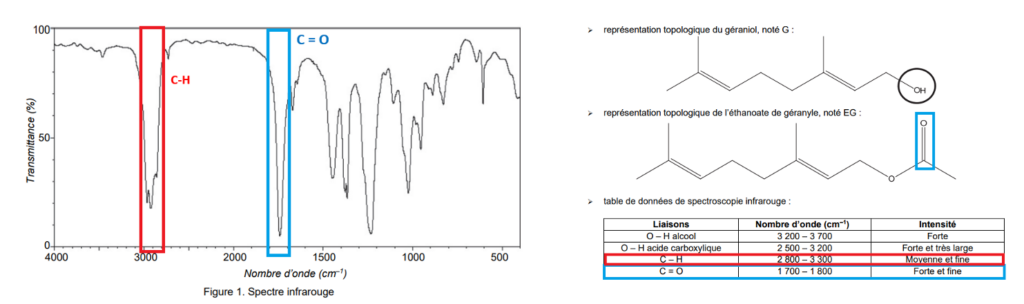
Le spectre d’absorption IR de l’échantillon présente :
- Une bande correspondant à une liaison C = O (nombre d’onde compris entre 1 700 – 1 800 cm-1)
- Une bande correspondant à une liaison C-H (nombre d’onde compris entre 2 800 – 3 300 cm-1)
Le spectre d’absorption IR ne présente pas de bande correspondant à une liaison O-H (nombre d’onde compris entre 3 200 – 3 700 cm-1) : Ce n’est pas un Alcool donc pas le géraniol.
La bonne espèce chimique est l’éthanoate de géranyle.
2. Transformation du géraniol en éthanoate de géranyle
L’éthanoate de géranyle peut être synthétisé en faisant réagir du géraniol avec de l’acide éthanoïque CH3CO2H. Cette transformation chimique, appelée estérification, est lente et non totale. Les étapes du mécanisme réactionnel de cette estérification sont données ci-dessous. Afin de simplifier les écritures, le géraniol est dorénavant noté R–OH et l’éthanoate de géranyle est dorénavant noté CH3COO–R dans toute la suite de l’exercice.
Étape 1 :
Étape 2 :
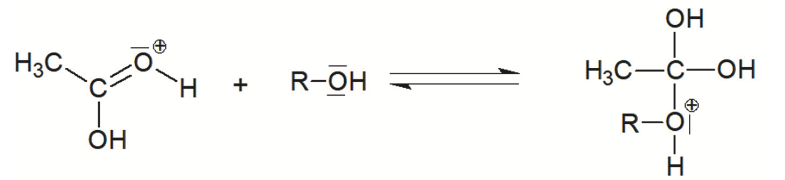
Étape 3 :
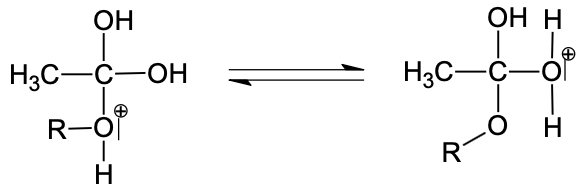
Étape 4 :
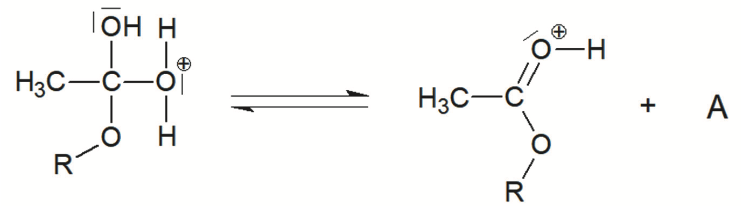
Étape 5 :
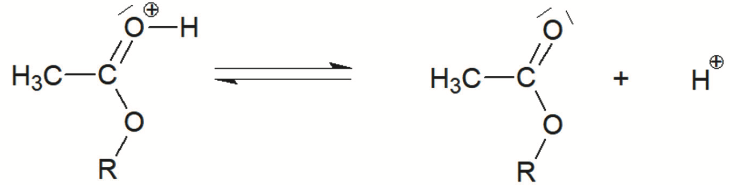
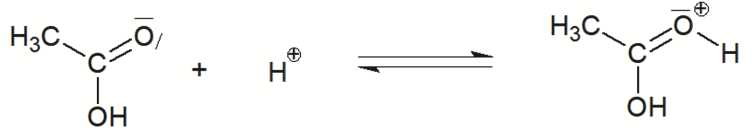
Q3. Rappeler la définition d’un catalyseur puis identifier, en justifiant, l’espèce chimique qui catalyse la réaction d’estérification.
Un catalyseur est une espèce chimique qui accélère une réaction sans apparaitre dans le bilan global de la réaction.
Q4. Représenter sur la figure A2 de l’ANNEXE À RENDRE AVEC LA COPIE, les flèches courbes expliquant la formation et/ou la rupture des liaisons mises en jeu lors des étapes 1, 2 et 5.
Lors d’une formation de liaison, le doublet d’électrons se déplace du site donneur vers un site accepteur.
Lors d’une rupture de liaison, la flèche part de la liaison vers l’atome le plus électronégatif.

Q5. Donner la formule brute de l’espèce chimique notée A dans l’étape 4 puis écrire l’équation de la réaction d’estérification entre le géraniol et l’acide éthanoïque.
Méthode 1 :
On compare les réactifs et les produits pour déterminer la formule de l’élément X :

Ainsi l’élément X est de l’eau de formule H2O.
Méthode 2 :
On compte les atomes des réactifs et des produits pour déterminer la formule de l’élément X :
| Atomes | Réactifs | Produits | Différence |
| R (groupement d’atomes) | 1 | 1 | 0 |
| C | 2 | 2 | 0 |
| O | 3 | 2 | 1 |
| H | 6 | 4 | 2 |
Ainsi, l’élément X est formé de 1 atome d’oxygène et 2 atomes d’hydrogène : l’élément X est de l’eau de formule H2O.
La synthèse de l’éthanoate de géranyle est réalisée en laboratoire avec le protocole expérimental suivant :
- dans un erlenmeyer, surmonté d’un réfrigérant à air, introduire un volume VA = 50 mL d’une solution aqueuse d’acide éthanoïque à la concentration CA = 1,0 mol·L–1 ainsi qu’une masse mG = 7,7 g de géraniol pur ;
- ajouter deux gouttes d’acide sulfurique concentré (quantité négligeable devant la quantité d’acide éthanoïque introduit dans l’étape précédente) ;
- chauffer à 55 °C au bain-marie pendant deux heures ;
- verser le mélange refroidi dans une ampoule à décanter et séparer la phase aqueuse, qui contient l’acide éthanoïque restant, de la phase organique, qui contient l’éthanoate de géranyle synthétisé et le géraniol restant.
Q6. Indiquer l’intérêt de chauffer le mélange.
L’intérêt de chauffer le mélange est d’accélérer la réaction.
Q7. Indiquer, en justifiant, la position relative et le contenu des phases dans l’ampoule à décanter.
D’après le sujet : « la phase aqueuse, qui contient l’acide éthanoïque restant, de la phase organique, qui contient l’éthanoate de géranyle synthétisé et le géraniol restant »
- la densité d’une solution aqueuse d’acide éthanoïque est dA = 1,0
- la densité du géraniol : dG = 0,89
- la densité de l’éthanoate de géranyle : dEG = 0,92.
La densité la phase organique (qui contient l’éthanoate de géranyle synthétisé et le géraniol restant) est inférieure à celle de la solution aqueuse d’acide éthanoïque.
Ainsi, la phase organique sera au-dessus de la phase aqueuse.
Q8. Vérifier par le calcul que l’acide éthanoïque et le géraniol sont introduits dans les proportions stœchiométriques.
Calculons les quantités initiales des réactifs :
$$n_{acide\ ethanoique}=C_A\times V_A$$
$$n_{acide\ ethanoique}=1,0\times 50\times {10}^{-3}$$
$$n_{acide\ ethanoique}=5,0\times {10}^{-2}\ mol$$
$$n_{geraniol}=\frac{m_{geraniol}}{M_{geraniol}}$$
$$n_{geraniol}=\frac{7,7}{154,25}$$
$$n_{geraniol}=5,0\times {10}^{-2}\ mol$$
$$x_{max1}=\frac{n_{acide\ ethanoique}}{1}=\frac{5,0\times {10}^{-2}}{1}=5,0\times {10}^{-2}\ mol$$
$$x_{max2}=\frac{n_{geraniol}}{1}=\frac{5,0\times {10}^{-2}}{1}=5,0\times {10}^{-2}\ mol$$
$$x_{max}=x_{max1}=x_{max2}=5,0\times {10}^{-2}\ mol$$
Ainsi, l’acide éthanoïque et le géraniol sont introduits dans les proportions stœchiométriques.
Pour déterminer la quantité d’éthanoate de géranyle formée, on dose l’acide éthanoïque restant dans la phase aqueuse à l’aide d’une solution aqueuse d’hydroxyde de sodium à la concentration CB = 1,0 mol·L–1. Le titrage est suivi par pH-métrie et la courbe obtenue est représentée sur la figure 2.
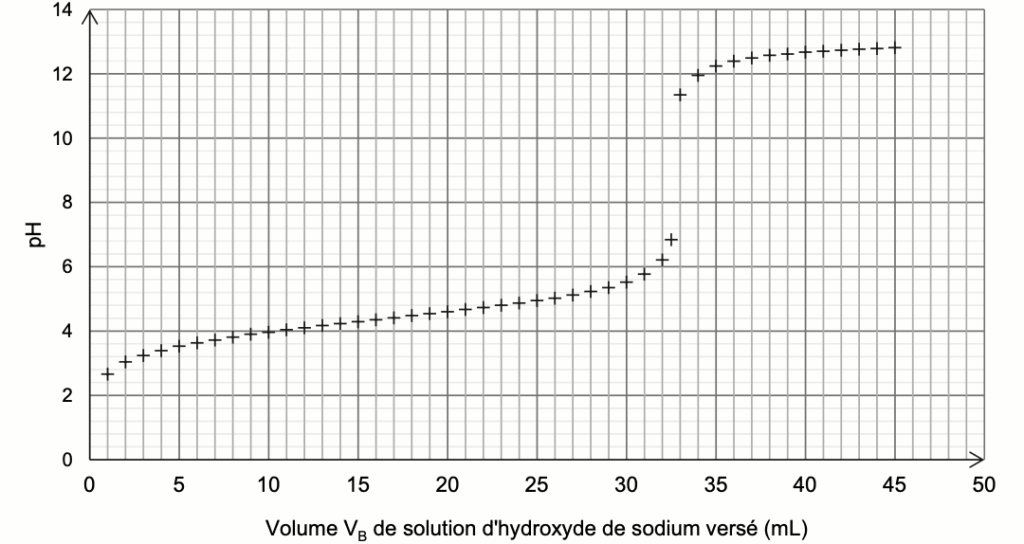
Figure 2. Courbe de titrage de l’acide éthanoïque restant par une solution d’hydroxyde de sodium
Q9. Écrire l’équation de la réaction support du titrage puis, à l’aide de la courbe de titrage, déterminer, en explicitant la démarche, la quantité de matière d’acide éthanoïque restant dans le milieu réactionnel après deux heures de chauffage.
On dose l’acide ethanoïque ${\rm CH}_3{\rm CO}_2H\left(aq\right)\ $ restant dans la phase aqueuse à l’aide d’une solution aqueuse d’hydroxyde de sodium $\left({\rm Na}^+\left(aq\right)+{\rm HO}^-\left(aq\right)\right)$.
L’équation de la réaction support du titrage est :
$${\rm CH}_3{\rm CO}_2H\left(aq\right)+{\rm HO}^-\left(aq\right)\rightarrow{{\rm CH}_3CO}_2^-\left(aq\right)+\ H_2O(l)$$
A l’equivalence :
$$\frac{n_{{\rm CH}3{\rm CO}2H}^{restant}}{1}=\frac{n_{{\rm HO}^-}^{eq}}{1}$$
$$n_{{\rm CH}3{\rm CO}2H}^{restant}=C_B\times V_E$$
On détermine graphiquement le volume à l’équivalence avec la méthode des tangentes parallèles : $V_E=33\ mL$
$$n_{{\rm CH}_3{\rm CO}_2H}^{restant}=1,0\times33\times{10}^{-3}$$
$$n_{{\rm CH}_3{\rm CO}_2H}^{restant}=3,3\times{10}^{-2}\ mol$$
Q10. Déterminer le rendement 𝜂 de la réaction d’estérification.
$$\eta=\frac{n_{ester}^{exp}}{n_{ester}^{th}}$$
Or
$$n_{ester}^{th}=x_{max}=5,0\times{10}^{-2}\ mol$$
$$n_{ester}^{exp}=x_f$$
$$n_{ester}^{exp}=n_{{\rm CH}3{\rm CO}2H}^{reagit}$$
$$n{ester}^{exp}=n{{\rm CH}_3{\rm CO}2H}^{initial}-n{{\rm CH}3{\rm CO}2H}^{restant}$$
$$n{ester}^{exp}=5,0\times{10}^{-2}\ -3,3\times{10}^{-2}$$
$$n{ester}^{exp}=1,7\times{10}^{-2}\ mol$$
$$\eta=\frac{n_{ester}^{exp}}{n_{ester}^{th}}$$
$$\eta=\frac{1,7\times{10}^{-2}}{5,0\times{10}^{-2}}$$
$$\eta=0,34$$
$$\eta=34%$$
3. Utilisation du géraniol en parfumerie
Le géraniol fait partie des substances allergènes que l’on retrouve dans les parfums. Une personne peut être exposée sans risque à une dose de géraniol inférieure à 17,75 mg par kg de masse corporelle.
Les informations suivantes sont recueillies sur l’étiquette d’un parfum vendu dans le commerce :
- le parfum contient 0,001 % en masse de géraniol ;
- une pulvérisation contient 0,15 mL de parfum ;
- la densité du parfum est d = 0,84.
Q11. Déterminer le nombre maximal de pulvérisations d’un parfum qu’une personne, de masse 65 kg, peut effectuer sans se mettre en danger. Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Calculons la masse contenue dans une pulvérisation :
$$\rho_{sol}=\frac{m_{sol}}{V_{sol}}$$
$$\frac{m_{sol}}{V_{sol}}=\rho_{sol}$$
$$m_{sol}=\rho_{sol}\times V_{sol}$$
Or
$$d_{sol}=\frac{\rho_{sol}}{\rho_{eau}}$$
$$\frac{\rho_{sol}}{\rho_{eau}}=d_{sol}$$
$$\rho_{sol}=d_{sol}\times \rho_{eau}$$
D’ou
$$m_{sol}=d_{sol}\times \rho_{eau}\times V_{sol}$$
Or le parfum contient 0,001 % en masse de geraniol ;
$$P_{geraniol}=\frac{m_{geraniol}}{m_{sol}}$$
$$\frac{m_{geraniol}}{m_{sol}}=P_{geraniol}$$
$$m_{geraniol}=P_{geraniol}\times m_{sol}$$
D’où
$$m_{geraniol}=P_{geraniol}\times d_{sol}\times \rho_{eau}\times V_{sol}$$
$$m_{geraniol}=\frac{0,001}{100}\times 0,84\times 1000\times 0,15\times {10}^{-3}$$
$$m_{geraniol}=1,26\times {10}^{-6}\ g$$
D’après l’enonce : « une personne peut être exposee sans risque à une dose de geraniol inferieure à 17,75 mg par kg de masse corporelle. »
Considerons une personne de 65kg et calculons la masse maximale de geraniol à laquelle il peut être expose :
$$m_{geraniol,\ max}=65\times 17,75\times {10}^{-3}\ g$$
$$m_{geraniol,\ max}=1,15\ g$$
| 1 pulvérisation | $m_{geraniol}=1,26\times {10}^{-6}\ g$ |
| N pulvérisations | $m_{geraniol,\ max}=1,15\ g$ |
$$N=\frac{1,24\times 1}{1,15\times {10}^{-6}}$$
$$N=9,1\times {10}^5$$
Ainsi, le nombre maximal de pulvérisations d’un parfum qu’une personne, de masse 65 kg, peut effectuer sans se mettre en danger est de $$N=9,1\times {10}^5$$ pulvérisation.
Ce nombre est gigantesque, il n’y a donc aucun risque pour la sante.
ANNEXE À RENDRE AVEC LA COPIE
Étape 1 :

Étape 2 :

Étape 3 :

Étape 4 :

Étape 5 :

