E3C2 – 10 points – Durée 1h – calculatrice autorisée
Des algues provenant de la haute mer s’échouent sur les côtes martiniquaises. Ces algues ne sont pas toxiques en elles-mêmes. Mais elles meurent une fois échouées sur les plages. Des dégagements importants de gaz sont produits lors de leur décomposition, notamment du sulfure d’hydrogène H2S, qui provoquent des nuisances olfactives et des troubles sanitaires.

Selon les doses, les effets peuvent être une irritation des yeux (conjonctivite, gène à la lumière vive) et des voies respiratoires (rhinite, enrouement, toux, douleur thoracique, etc). Les personnes asthmatiques y sont particulièrement sensibles, ainsi que les jeunes enfants et les femmes enceintes.
https://www.martinique.ars.sante.fr/les-algues-sargasses-une-nouveau-phenomene-sanitaire
On se propose d’étudier la structure la molécule de sulfure d’hydrogène ainsi que ses propriétés et de les comparer à celles d’autres molécules connues.
Données
Tableau périodique des éléments et échelle d’électronégativité de Pauling
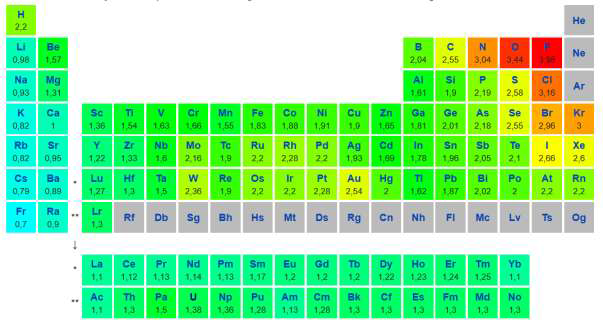
Table de données pour la spectroscopie infrarouge
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H alcool | 3200-3400 | forte |
| N-H amine | 3100-3500 | moyenne |
| Ctri-H | 3000-3100 | moyenne |
| Ctét-H | 2800-3000 | forte |
| O-H acide carboxylique | 2500-3200 | forte à moyenne, large |
| S-H | 2550 -2620 | moyenne |
| C=O ester | 1700-1740 | forte |
| C=O aldéhyde ou cétone | 1650-1730 | forte |
| C=O acide carboxylique | 1680-1710 | forte |
| N-H amine ou amide | 1560-1640 | forte |
Ctri signifie que l’atome de carbone est trigonal, c’est-à-dire relié à trois voisins.
Ctét signifie que l’atome de carbone est tétragonal, c’est-à-dire relié à quatre voisins.
Énergies de liaison
| Liaison | Energie (kJ.mol-1) |
| O=O | 500 |
| H-S | 350 |
| C=O | 800 |
| O-H | 450 |
| S=O | 550 |
1. L’oxygène, le soufre et le sélénium appartiennent à la même colonne du tableau périodique.
1.1. Établir le schéma de Lewis de la molécule de sulfure d’hydrogène, H2S, et proposer une géométrie de cette entité. Justifier votre raisonnement.
1.2. La molécule de sulfure d’hydrogène est-elle polaire ? Justifier votre réponse.
2. La solubilité d’une espèce chimique est la concentration maximale de cette espèce que l’on peut dissoudre dans l’eau. Elle dépend de la température. Le tableau ci-dessous indique la solubilité du gaz H2S dans l’eau, ainsi que celles d’autres espèces chimiques à la pression atmosphérique et à une température de 25°C.
| Nom de l’espèce chimique | Formule chimique | Solubilité (en mol.L-1) |
| Diiode | I2 | 1,3 x 10-3 |
| sulfure d’hydrogène | H2S | 2,5 |
| Ammoniac | NH3 | 50 |
Proposer une interprétation pour expliquer l’évolution de la solubilité dans l’eau des espèces chimiques ci-dessus. Une argumentation détaillée est attendue.
3. Des détecteurs de sulfure d’hydrogène ont été placés aux abords des rivages où s’échouent les sargasses. Certains de ces détecteurs contiennent des cellules électrochimiques. Il s’agit de capteurs dont le principe de fonctionnement repose sur une transformation chimique modélisée par une réaction d’oxydo-réduction ; le sulfure d’hydrogène y est oxydé par le dioxygène de l’air. Les couples oxydants-réducteurs mis en jeu sont les suivants : H2SO4/H2S et O2/H2O (correction du sujet officiel qui indique O2/H2)
On propose ci-dessous le schéma de Lewis de la molécule d’acide sulfurique H2SO4
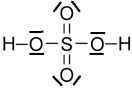
3.1. En comparant les schémas de Lewis des molécules de sulfure d’hydrogène H2S et d’acide sulfurique H2SO4, indiquer quelle est la particularité de l’atome de soufre dans la molécule d’acide sulfurique.
3.2. Montrer que l’équation de la réaction modélisant la transformation chimique au sein du capteur est la suivante : H2S + 2 O2 → H2SO4.
4. Le sulfure d’hydrogène produit lors de la décomposition des algues provient de la dégradation d’un acide aminé, la L-Cystéine dont la formule semi-développée est représentée ci-contre.
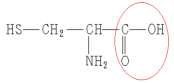
4.1. À quelle famille de composés est associé le groupe caractéristique entouré sur la formule de la L-Cystéine ?
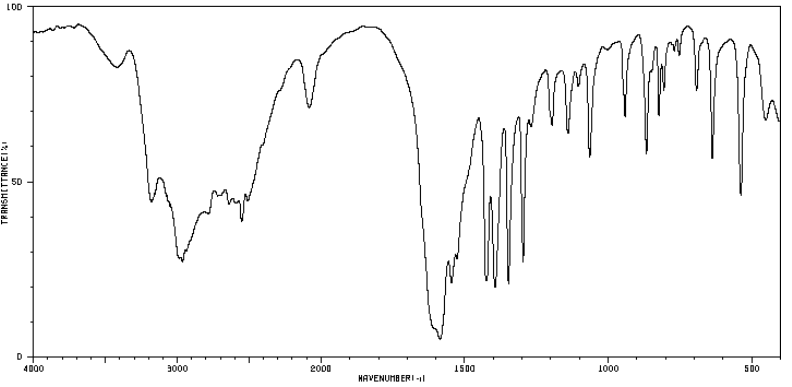
4.2. Les groupes caractéristiques présents dans cette molécule peuvent être identifiés grâce à la spectroscopie infrarouge (I.R.).
Justifier ce spectre reproduit puisse correspondre à la L-Cystéine.
5. De nombreuses solutions sont envisagées afin de traiter les sargasses collectées après chaque échouage. Notamment, la combustion des algues afin de produire de l’énergie électrique.
https://martinique.ademe.fr/sites/default/files/situation-perspectives-valorisation-sargasses.pdf
L’un des inconvénients de la combustion de la sargasse est que le sulfure d’hydrogène et son produit de combustion, le dioxyde de soufre, SO2, réagissent avec les métaux et forment des produits noirs à leur surface.
5.1. Sachant que l’eau est l’autre produit de la combustion de H2S, écrire l’équation de la réaction modélisant la combustion du sulfure d’hydrogène dans l’air.
5.2. A partir des données, évaluer l’énergie molaire de la combustion du sulfure d’hydrogène. Le schéma de Lewis du dioxyde de soufre est représenté ci-dessous.
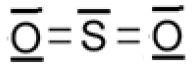
5.3. Cette transformation est-elle endothermique ou exothermique ? Justifier votre réponse.
