Bac Métropole 2024 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°24-PYCJ1ME1
Sujet et corrigé
Exercice 1 – Vers le bleu de thymol (9 points)
Le bleu de thymol est un indicateur coloré acido-basique de plus en plus utilisé dans les laboratoires. Suivant les recommandations de l’INRS (Institut National de Recherche et de Sécurité), il se substitue en effet à la phénolphtaléine, couramment utilisée auparavant, et qui est désormais classée CMR (Cancérigène Mutagène Reprotoxique). Comme le montre la figure 1, le bleu de thymol peut être synthétisé à partir du thymol, lui-même extrait de la plante de thym ou synthétisé à partir du m-crésol.
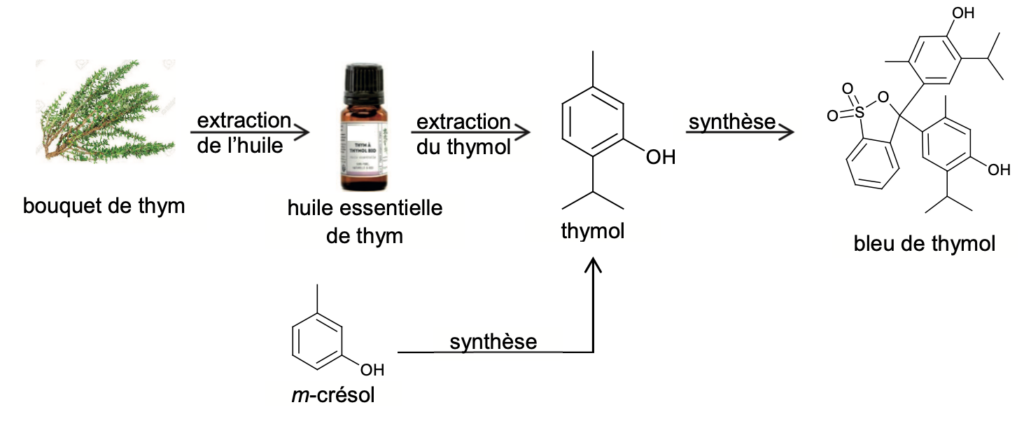
Figure 1. Modes d’obtention possibles du bleu de thymol
L’objectif de cet exercice est d’étudier deux modes d’obtention du thymol puis de s’intéresser au bleu de thymol en tant qu’alternative à la phénolphtaléine comme indicateur coloré.
1. Extractions successives
Le thym est une petite plante cultivée depuis l’antiquité dans les régions du pourtour méditerranéen. Appréciée en cuisine pour ses arômes, la plante est également utilisée pour ses vertus thérapeutiques dues au thymol, constituant principal de l’espèce de thym étudiée dans cet exercice.
Données :
- le thymol, à température ambiante, se présente sous la forme de cristaux incolores à l’odeur caractéristique ;
- la solubilité du thymol est faible dans l’eau et forte dans les solvants organiques ;
- le traitement d’un échantillon de 100 g de thym d’origine française permet d’obtenir au maximum 2 g d’huile essentielle de thym ;
- la configuration électronique de l’oxygène dans son état fondamental est : (1s)2(2s)2(2p)4 ;
- l’hexane est un solvant organique de densité d = 0,66 et non miscible à l’eau ;
- le couple thymol / ion thymolate est noté : R–OH / R–O –.
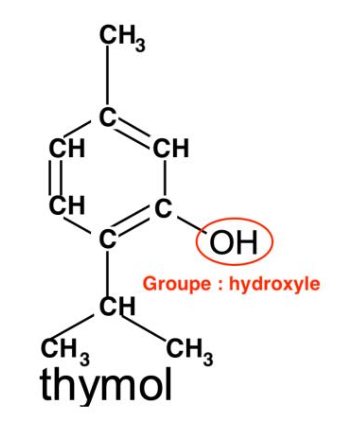
Q1. Écrire la formule semi-développée du thymol puis entourer et nommer son groupe caractéristique.
Formule semi-développée du thymol :
Groupe : hydroxyle
Q2. Représenter le schéma de Lewis de l’ion thymolate, noté R–O–.
Schéma de Lewis de l’ion thymolate :
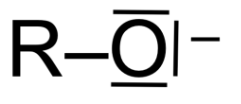
Du thym à l’huile essentielle de thym
L’hydrodistillation est l’une des techniques d’extraction des huiles essentielles préconisées par la législation européenne.
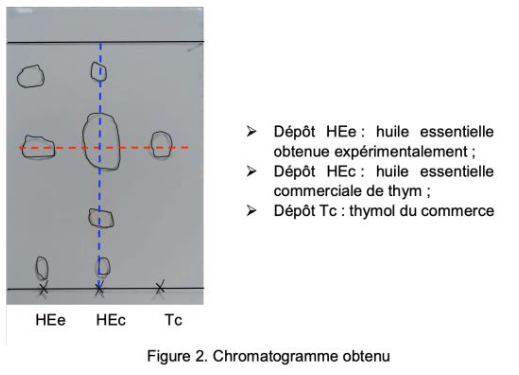
Suite à l’hydrodistillation d’un échantillon de thym, on réalise une chromatographie sur couche mince de l’huile essentielle obtenue, les échantillons étant solubilisés dans un solvant adapté. Le chromatogramme est représenté figure 2.

- Dépôt HEe : huile essentielle obtenue expérimentalement ;
- Dépôt HEc : huile essentielle commerciale de thym ;
- Dépôt Tc : thymol du commerce
Figure 2. Chromatogramme obtenu
Q3. Justifier que l’huile essentielle obtenue expérimentalement est un mélange qui contient du thymol.
Le dépôt HEc (huile essentielle obtenue expérimentalement) donne 4 taches : c’est donc un mélange. Une des taches est au même niveau que la tache correspondant au dépôt TC (Thymol du commerce) : l’huile essentielle obtenue expérimentalement qui contient du thymol.
Ainsi, l’huile essentielle obtenue expérimentalement est un mélange qui contient du thymol.
De l’huile essentielle au thymol
Un article scientifique propose le protocole d’extraction du thymol de l’huile essentielle suivant :
- ajouter 1,0 mL d’huile essentielle de thym à 5 mL de solution aqueuse d’hydroxyde de sodium ;
- après chauffage dans un four à micro-ondes, éliminer la phase huileuse puis acidifier la phase aqueuse à l’aide d’acide chlorhydrique ;
- ajouter de l’hexane, agiter, laisser décanter et récupérer la phase contenant le thymol.
Après évaporation du solvant, on obtient des cristaux dont la masse correspond à 31 % de la masse de thymol présent initialement dans l’huile essentielle.
D’après Journal of Medicinal Plants and By-products, 2021
Donnée :
- Le pourcentage massique moyen en thymol de l’huile essentielle de thym est de 53 %.
Q4. Écrire l’équation de la réaction modélisant l’action de l’acide chlorhydrique sur l’ion thymolate R–O–.
$R!-!O^-\left(aq\right)+H_3O^+\left(aq\right)\rightarrow R!-!OH\left(aq\right)+H_2O\left(aq\right)$
Remarque : l’acide chlorhydrique est un acide fort, la réaction est totale d’où la flèche simple dans l’équation.
Q5. En déduire la nature et la position de la phase dans laquelle se trouve le thymol à l’issue de la décantation.
Au cours du protocole d’extraction du thymol, on ajoute de l’hexane.
Selon les données :
L’hexane est un solvant organique de densité $d=0,66$ et non miscible à l’eau.
La solubilité du thymol est faible dans l’eau et forte dans les solvants organiques.
Ainsi, le thymol se trouve dans l’hexane (phase organique) qui est au-dessus de la phase aqueuse car sa densité est inférieure à celle de l’eau.
Q6. Montrer que la masse de plante de thym à utiliser pour obtenir 1 g de thymol vaut près de 300 g.
Méthode 1 :
D’après les données : Après évaporation du solvant, on obtient des cristaux dont la masse correspond à 31 % de la masse de thymol présent initialement dans l’huile essentielle.
$P_1=\frac{m_{thymol\ }}{m_{thymol\ ini\ }}$
$P_1\times m_{thymol\ ini\ }=m_{thymol\ }$
$m_{thymol\ ini\ }=\frac{m_{thymol\ }}{P_1}$
$m_{thymol\ ini\ }=\frac{1,0}{0,31}$
$m_{thymol\ ini\ }=3,2\ g$
D’après les données : Le pourcentage massique moyen en thymol de l’huile essentielle de thym est de 53 %.
$P_2=\frac{m_{thymol\ ini\ }}{m_{huile\ }}$
$P_2\times m_{huile\ }=m_{thymol\ ini\ }$
$m_{huile\ }=\frac{m_{thymol\ ini\ }}{P_2}$
$m_{huile\ }=\frac{3,2}{0,53}$
$m_{huile\ }=6,0\ g$
D’après les données : le traitement d’un échantillon de 100 g de thym d’origine française permet d’obtenir au maximum 2 g d’huile essentielle de thym.
| 100 g de thym | 2 g d’huile essentielle de thym |
| m de thym | 6,0 g d’huile essentielle de thym |
${m_\ }{thym}=\frac{6,0\times100}{2}$
${m\ }_{thym}=300\ g$
Ainsi, la masse de plante de thym à utiliser pour obtenir 1 g de thymol vaut près de 300 g.
Méthode 2 :
D’après les données :
Le traitement d’un échantillon de 100 g de thym d’origine française permet d’obtenir au maximum 2 g d’huile essentielle de thym.
Le pourcentage massique moyen en thymol de l’huile essentielle de thym est de 53 %.
Ainsi, dans 100 g de thym, il y a :
$m_{thymol}=0,53\times2,0=1,06\ g\ de\ thymol$
D’après les données : Après évaporation du solvant, on obtient des cristaux dont la masse correspond à 31 % de la masse de thymol présent initialement dans l’huile essentielle.
Ainsi, dans 100 g de thym, il y a :
$m_{thymol\ extrait}=0,31\times m_{thymol}=0,31\times1,06=0,33\ g\ de\ thymol$
Masse de plante de thym à utiliser pour obtenir 1 g de thymol :
| 100 g de thym | 0,33 g de thymol |
| m de thym | 1 g de thymol |
${m_\ }{thym}=\frac{1\times100}{0,33}$
${m\ }_{thym}=303\ g$
Ainsi, la masse de plante de thym à utiliser pour obtenir 1 g de thymol vaut près de 300 g.
2. Synthèse du thymol
Le thymol utilisé dans les produits pharmaceutiques est principalement obtenu par synthèse. Comme indiqué en figure 3, le thymol peut être industriellement synthétisé à partir de m-crésol et de propène en excès, en présence d’oxyde d’aluminium, qui joue ici le rôle de catalyseur. Cette transformation génère plusieurs produits secondaires et rend complexe l’obtention sélective du thymol.
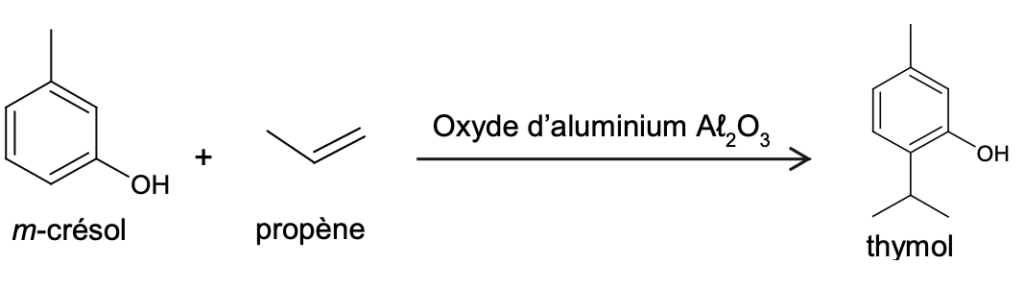
Figure 3. Exemple d’un procédé de synthèse du thymol
Données :
- masse volumique de l’eau : 1,00×103 g·L–1 ;
- tableau rassemblant des propriétés physiques et chimiques de quelques molécules :
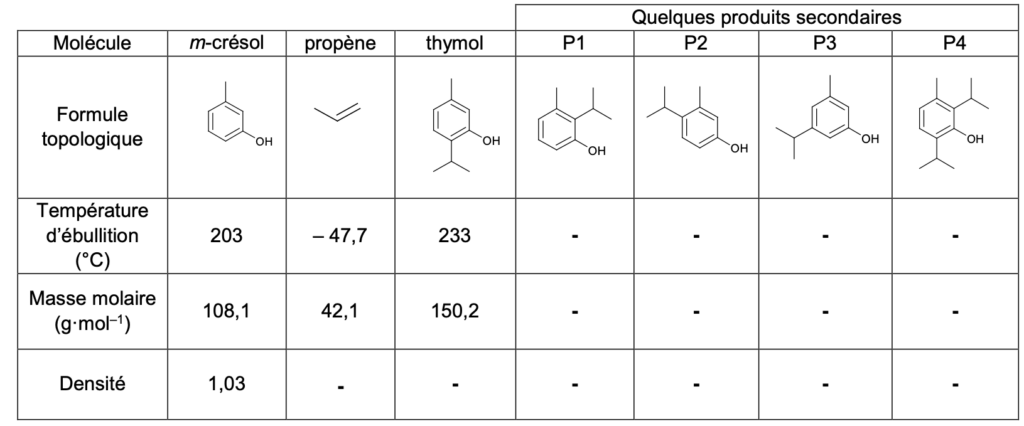
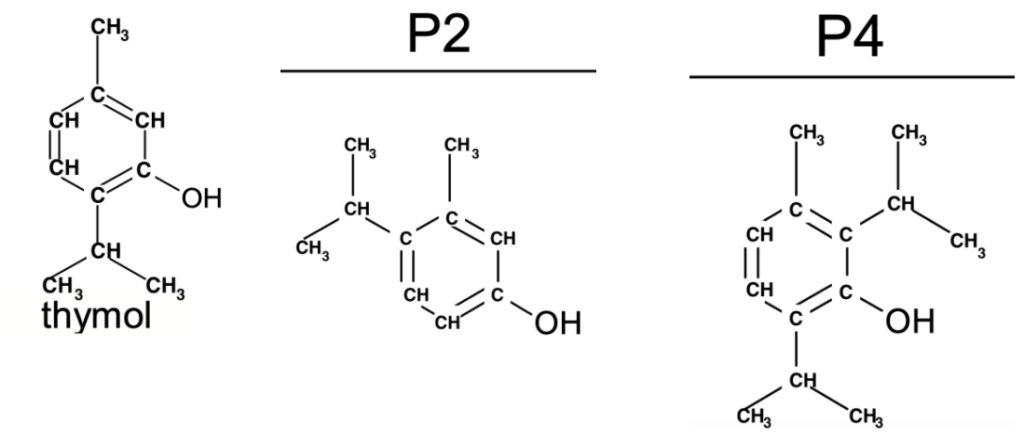
Q7. Déterminer si les produits secondaires P2 et P4 de la réaction sont des isomères du thymol.
Des isomères ont une formule brute identique et une formule développée différente.
Formule brute du thymol : C10H14O
Formule brute de P2 : C10H14O
Formule brute de P4 : C13H20O
Le produit secondaire P2 et le thymol ont la même formule brute et une formule développée différente : ce sont des isomères.
Le produit secondaire P4 et le thymol n’ont pas la même formule brute : ce ne sont pas des isomères.
De nombreux catalyseurs ont récemment été développés dans le but, entre autres, de réduire la température de la synthèse et d’obtenir une sélectivité maximale en thymol.
Q8. Donner la définition d’un catalyseur et indiquer en quoi son utilisation peut permettre de « réduire la température de la synthèse ».
Un catalyseur est une espèce chimique qui accélère la réaction chimique sans modifier la composition du système à l’état final.
Réduire la température de la synthèse provoque la diminution de la vitesse de la synthèse. Ainsi l’utilisation d’un catalyseur qui accélère la synthèse permet de réduire la température sans que la vitesse globale de la réaction ne diminue.
On considère que la transformation entre le m-crésol et le propène n’est pas totale et que l’état final de la transformation est un état d’équilibre chimique.
Q9. Expliquer l’intérêt d’introduire le propène en excès dans cette synthèse industrielle.
Introduire un réactif en excès (ici le propène) permet de déplacer l’équilibre chimique et d’augmenter le rendement de la synthèse.
Une distillation fractionnée industrielle permet de purifier le thymol et de récupérer le m-crésol n’ayant pas réagi en vue de son recyclage.
Q10. Justifier que le thymol et le m-crésol peuvent a priori être séparés lors de la distillation fractionnée. Indiquer l’espèce que l’on récupèrerait en premier.
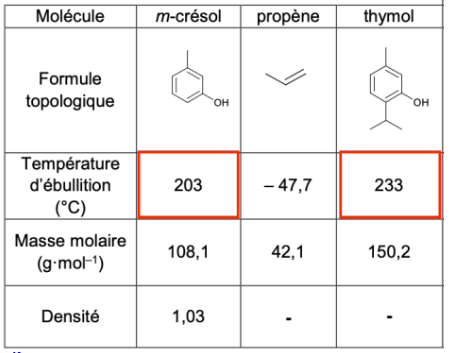
Le thymol et le m-crésol ont des températures d’ébullition différentes. Ainsi, ils peuvent a priori être séparés lors de la distillation fractionnée.
La température d’ébullition du m-crésol étant inférieure à celle du thymol, on récupèrerait en premier le m-crésol.
Q11. En considérant le m-crésol comme réactif limitant dans la transformation, dont le rendement est de 73 %, vérifier que le volume de m-crésol nécessaire pour synthétiser 1,0 g de thymol par le procédé de la figure 3 est inférieur à 1 mL.
Le rendement est défini par :
$\eta=\frac{n_{thymol,exp}}{n_{thymol,th}}$
Or
$n_{thymol,exp}=\frac{m_{thymol,exp}}{M_{thymol}}$
D’ou
$\eta=\frac{\frac{m_{thymol,exp}}{M_{thymol}}}{n_{thymol,th}}$
$\eta=\frac{m_{thymol,exp}}{n_{thymol,th}\times M_{thymol}}$
Or
$n_{thymol,th}=x_f=\frac{n_{reactif\ lim}}{1}=n_{m-cresol}$
D’ou
$\eta=\frac{m_{thymol,exp}}{n_{m-cresol}\times M_{thymol}}$
Or
$n_{m-cresol}=\frac{m_{m-cresol}}{M_{m-cresol}}=\frac{\rho_{m-cresol}\times V_{m-cresol}}{M_{m-cresol}}$
D’ou
$\eta=\frac{m_{thymol,exp}}{\frac{\rho_{m-cresol}\times V_{m-cresol}}{M_{m-cresol}}\times M_{thymol}}$
$\eta=\frac{m_{thymol,exp}\times M_{m-cresol}}{\rho_{m-cresol}\times V_{m-cresol}\times M_{thymol}}$
$\eta\times V_{m-cresol}=\frac{m_{thymol,exp}\times M_{m-cresol}}{\rho_{m-cresol}\times M_{thymol}}$
$V_{m-cresol}=\frac{m_{thymol,exp}\times M_{m-cresol}}{\eta\times\rho_{m-cresol}\times M_{thymol}}$
Or
$\rho_{m-cresol}=d_{m-cresol}\times\rho_{eau}$
D’ou
$V_{m-cresol}=\frac{m_{thymol,exp}\times M_{m-cresol}}{\eta\times d_{m-cresol}\times\rho_{eau}\times M_{thymol}}$
$V_{m-cresol}=\frac{1,0\times108,1}{0,73\times1,03\times1000\times150,2}$
$V_{m-cresol}=9,6\times{10}^{-4}L$
$V_{m-cresol}=0,96\ mL$
Ainsi, le volume de m-crésol nécessaire pour synthétiser 1,0 g de thymol par le procédé de la figure 3 est inférieur à 1 mL.
3. Le bleu de thymol
La phénolphtaléine est un indicateur coloré acide-base adapté pour les titrages d’acide faible. L’objectif de cette partie est de montrer qu’il en est de même pour le bleu de thymol.
Données :
- phénolphtaléine : indicateur coloré acide-base passant de l’incolore au rose dans la zone de virage expérimentale de pH [8,2 – 9,9] ;
- bleu de thymol : indicateur coloré acide-base ayant trois formes participant à deux couples acide-base d’écriture simplifiée BTH2(aq) / BTH–(aq) et BTH–(aq) / BT2–(aq) ;
- pour discuter de l’accord du résultat d’une mesure avec une valeur de référence, on peut utiliser le quotient $\frac{\left|x-x_{ref}\right|}{u(x)} $ avec x la valeur mesurée, xref la valeur de référence et u(x) l’incertitude-type associée à la valeur mesurée x.
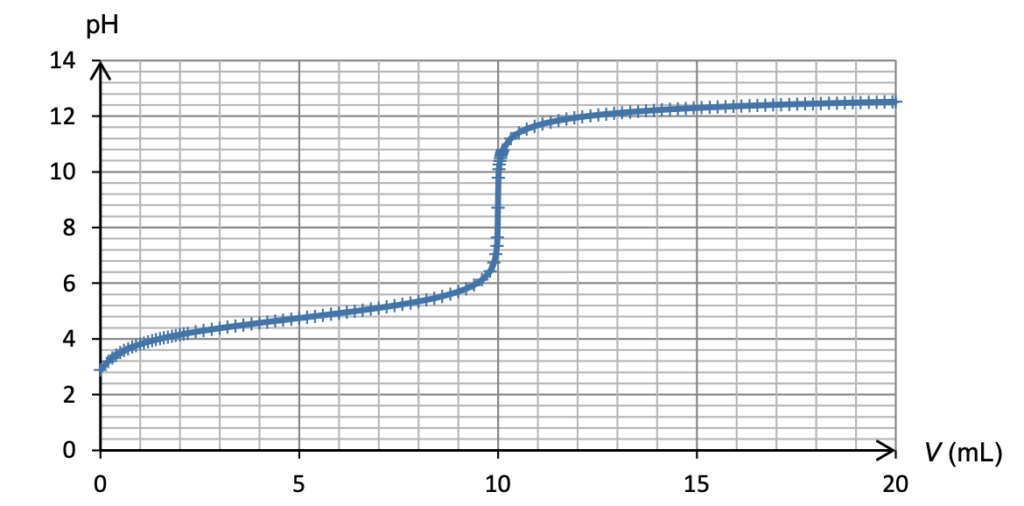
Figure 4. Simulation du titrage de 10,0 mL d’une solution d’un acide faible (acide éthanoïque) de concentration 0,100 mol·L–1 par une solution de base forte (hydroxyde de sodium) de concentration 0,100 mol·L–1
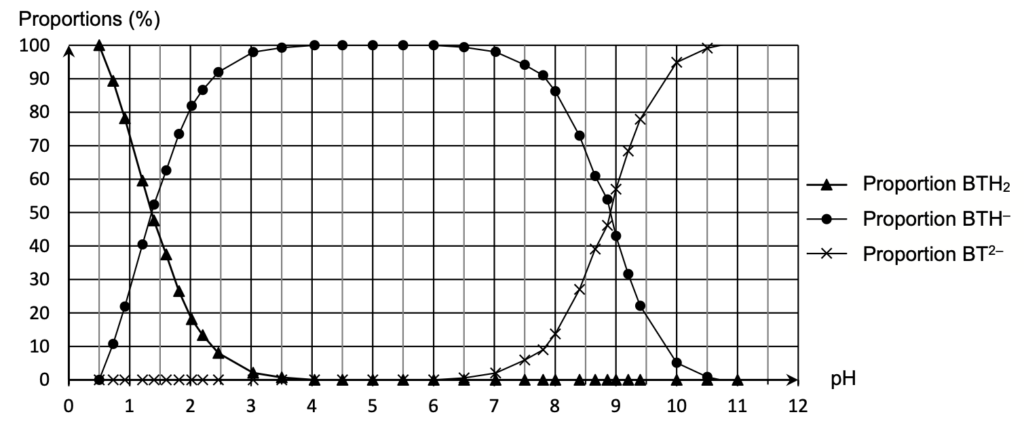
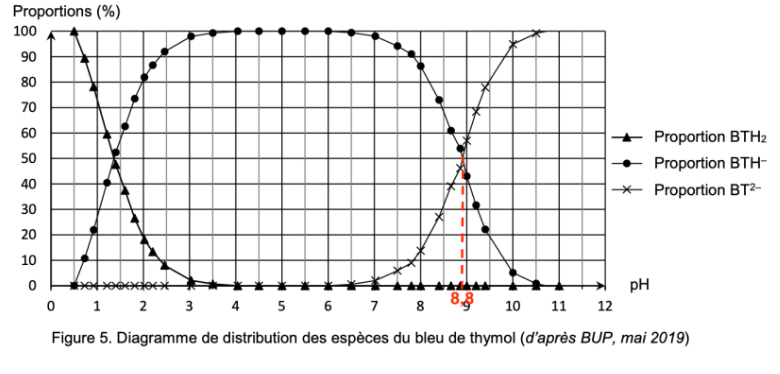
Figure 5. Diagramme de distribution des espèces du bleu de thymol (d’après BUP, mai 2019)
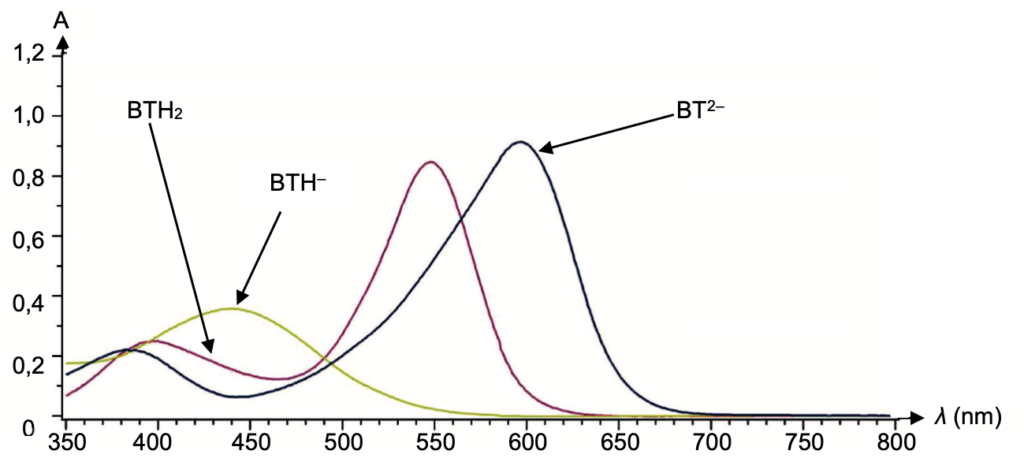
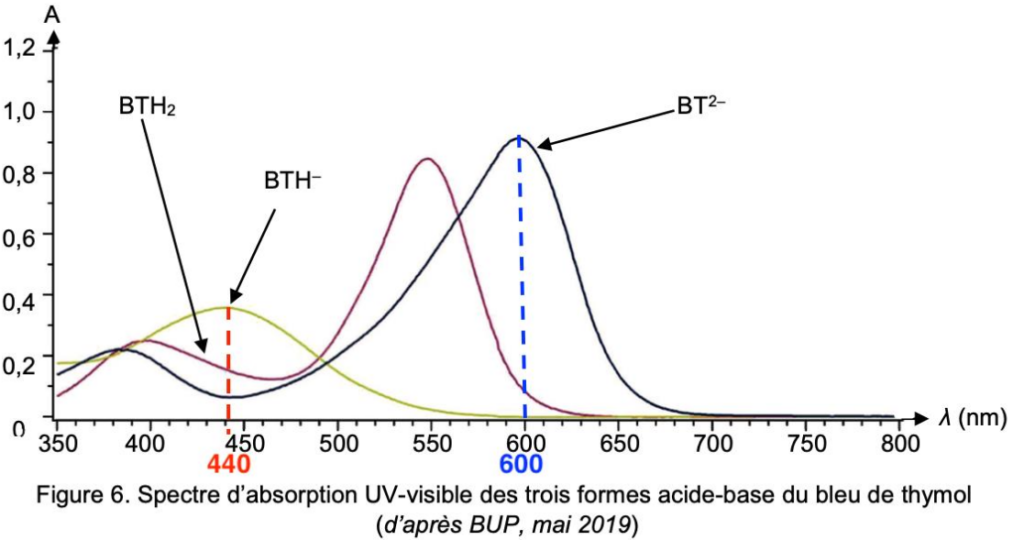
Figure 6. Spectre d’absorption UV-visible des trois formes acide-base du bleu de thymol (d’après BUP, mai 2019)
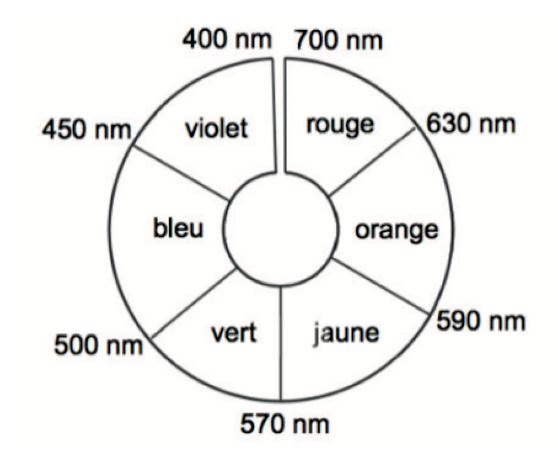
Figure 7. Cercle chromatique.
Q12. Parmi les espèces participant aux couples acide-base du bleu de thymol, identifier la forme amphotère.
Les couples sont :
BTH2/BTH–
BTH–/ BT2–
Une espèce amphotère est l’acide d’un couple et la base d’un autre : BTH– est l’espèce amphotère.
Q13. Exprimer la constante d’acidité KA d’un couple acide-base noté HA / A– en fonction des concentrations des espèces associées à l’équilibre.
$K_A=\frac{\left[A^-\right]{eq}\times\left[H_3O^+\right]{eq}}{\left[AH\right]_{eq}\times c^0}$
Q14. À l’aide de l’ensemble des informations proposées, déterminer la valeur du pKA du couple BTH–(aq) / BT2–(aq) du bleu de thymol. Justifier que celui-ci puisse remplacer la phénolphtaléine dans nos laboratoires, en précisant le changement de couleur observé lors du titrage d’un acide faible par une base forte.
Le candidat est invité à prendre des initiatives et à présenter sa démarche même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite donc d’être correctement présentée.
Lorsque $\left[A^-\right]{eq}=\left[AH\right]{eq}$, pH=pKA
Graphiquement, lorsque
$\left[{\rm BTH}^-\right]{eq}=\left[{\rm BTH}^{2-}\right]{eq}$, pH=8,8
Ainsi, pKA=8,8
A l’aide la méthode des tangentes parallèles, déterminons le pHeq lors du titrage d’un acide faible par une base forte :
Graphiquement pHeq=8,5.
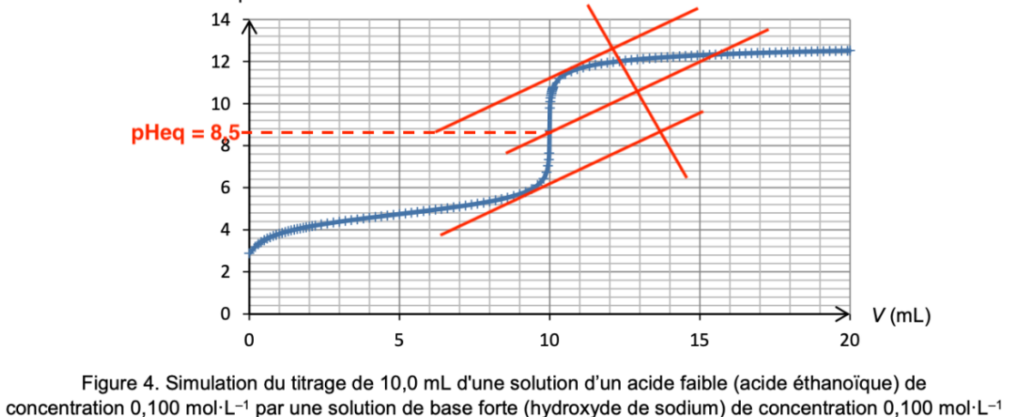
Le pKA=8,8 du bleu de thymol à une valeur proche du pHeq : le bleu de thymol est un indicateur coloré adapté à ce dosage.
D’après les données, la phénolphtaléine est un indicateur coloré acide-base passant de l’incolore au rose dans la zone de virage expérimentale de pH [8,2 – 9,9]. Le pKA=8,8 du bleu de thymol à une valeur comprise dans la zone de virage de la phénolphtaléine : le bleu de thymol est un indicateur coloré pouvant remplacer la phénolphtaléine.
Lors du dosage on passe de la forme BTH– à BTH2-.
Déterminons la couleur de ces deux formes
$\lambda_{max}({\rm BTH}^-)=440\ nm$
$\lambda_{max}({\rm BTH}^{2-})=600\ nm$
La couleur de la solution est la couleur complémentaire (diamétralement opposée sur le cercle chromatique) à celle absorbée.
BTH– absorbe le violet il est donc jaune
BTH2- absorbe le orange il est donc bleu.
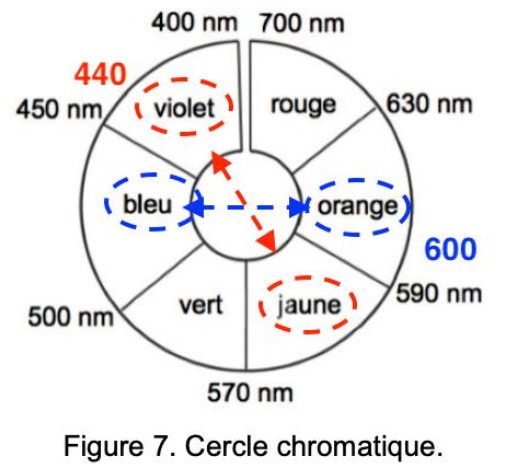
Ainsi, lors du dosage on passe de la forme BTH– à BTH2- on passe du jaune au bleu.
Q15. La valeur tabulée du pKA à 25°C du couple acide-base BTH–(aq) / BT2–(aq) est de 8,9. Indiquer si la valeur expérimentale obtenue est en accord avec celle-ci. L’incertitude-type associée au pKA déterminé par cette méthode est estimée à u(pKA) = 0,2.
Calculons le z-score :
$z=\frac{\left|pK_A-pK_{A,ref}\right|}{u\left(pK_A\right)}$
$z=\frac{\left|8,9-8,8\right|}{0,2}$
$z=0,5$
Le z-score est inférieur à 2 : la valeur expérimentale obtenue est en accord avec la valeur tabulée.
